Galzouten en galzuren zijn polaire cholesterolderivaten, en vormen de belangrijkste route voor de eliminatie van de steroïde uit het lichaam.
Het zijn moleculen met vergelijkbare, maar niet identieke structuren, en uiteenlopende fysische en biologische eigenschappen.
Zij worden gesynthetiseerd in de lever, opgeslagen in de galblaas, uitgescheiden in de twaalfvingerige darm, en tenslotte, voor het grootste deel, geherabsorbeerd in de kronkeldarm.
Omdat bij fysiologische pH deze moleculen aanwezig zijn als anionen, worden de termen galzuur en galzouten hierin als synoniemen gebruikt.
CONTENTEN
- Chemische structuur van galzouten
- Primaire, geconjugeerde en secundaire galzouten
- Functie van galzuren
- Enterohepatische circulatie van galzouten
- Intestinaal metabolisme van galzuren
- Oplosieve vezels en reabsorptie van galzouten
- Synthese van primaire galzuren
- De klassieke of neutrale route
- De alternatieve of zure route
- Minor pathways
- Bile zouten: regeling van de synthese
- Chemische structuur van galzouten
- Primaire, geconjugeerde en secundaire galzouten
- Functie van galzuren
- Enterohepatische circulatie van galzouten
- Intestinaal metabolisme van galzuren
- Oplosbare vezels en reabsorptie van galzouten
- Synthese van primaire galzuren
- De klassieke of neutrale route
- De alternatieve of zure route
- Minor pathways
- Galzouten: regulering van de synthese
Chemische structuur van galzouten
Galzouten hebben overeenkomsten en verschillen met cholesterolmolecule.
Zoals de steroïden hebben zij een kern die bestaat uit vier versmolten ringen: drie cyclohexaanringen, aangeduid met A, B en C, en een cyclopentaanring, aangeduid met D. Deze structuur is de perhydrocyclopentanofenantreen, beter bekend als steroïdenkern.
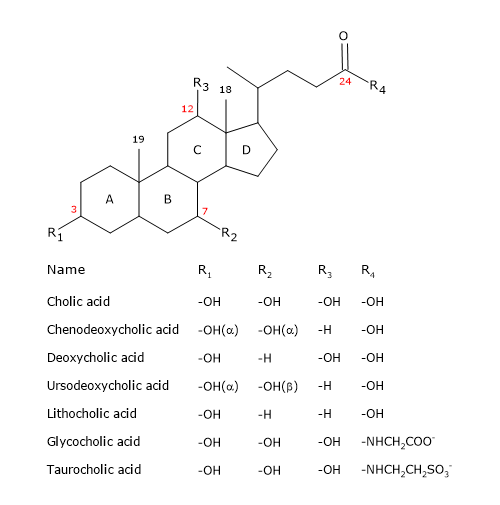
In hogere gewervelde dieren hebben zij 24 koolstofatomen, aangezien de zijketen drie koolstofatomen korter is dan het origineel. Bij lagere gewervelde dieren hebben galzuren 25, 26 of 27 koolstofatomen. De zijketen eindigt met een carboxylgroep, geïoniseerd bij pH 7, die kan worden gekoppeld aan het aminozuur glycine of taurine (zie hieronder).
Naast de hydroxylgroep op positie 3, hebben zij hydroxylgroepen op posities 7 en/of 12.
Dit alles maakt hen veel polairder dan cholesterol.
Omdat de A- en B-ringen in cis-configuratie zijn gefuseerd, is de planaire structuur van de steroïdenkern gebogen, en is het mogelijk:
- een holle zijde te identificeren, die hydrofiel is omdat de hydroxylgroepen en de carboxylgroep van de zijketen, met of zonder het gekoppelde aminozuur, erop georiënteerd zijn;
- een bolle zijde, die hydrofoob is omdat de methylgroepen op positie 18 en 19 erop georiënteerd zijn.
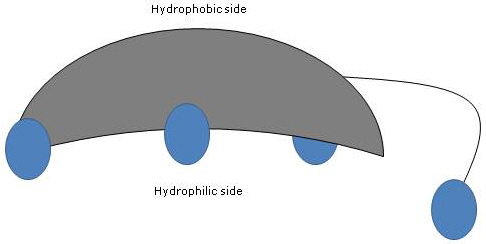
Dus met zowel polaire als niet-polaire groepen zijn het amfifiele moleculen en uitstekende oppervlakte-actieve stoffen. Door hun chemische structuur verschillen zij echter van veel andere oppervlakte-actieve stoffen, die vaak bestaan uit een polair hoofdgedeelte en een niet-polaire staart.
Primaire, geconjugeerde en secundaire galzouten
Primaire galzuren zijn die welke rechtstreeks uit cholesterol in de hepatocyten worden gesynthetiseerd. Bij de mens zijn cholzuur en chenodeoxycholzuur, die 80% van alle galzuren uitmaken, de belangrijkste. Alvorens in de galwegen te worden uitgescheiden, worden zij bijna volledig, tot 98%, geconjugeerd met glycine of taurine, om respectievelijk glycoconjugaten en tauroconjugaten te vormen. In het bijzonder worden ongeveer 75% van het cholzuur en chenodeoxycholzuur geconjugeerd met glycine, om glycocholzuur en glycochenodeoxycholzuur te vormen, en de resterende 25% met taurine, om taurocholzuur en taurochenodeoxycholzuur te vormen.
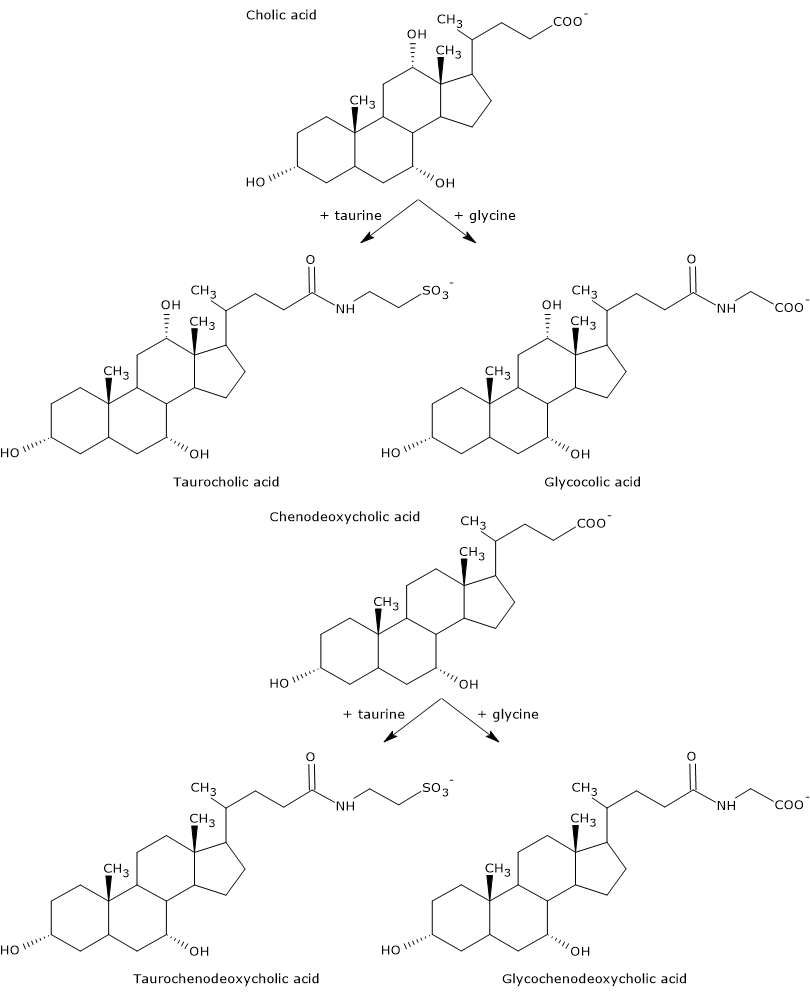
Geconjugeerde galzuren zijn moleculen met meer hydrofiele groepen dan niet-geconjugeerde galzuren, en dus met een groter emulgerend vermogen. Door conjugatie daalt de pKa van galzuren, van ongeveer 6, een waarde die typisch is voor niet-geconjugeerde moleculen, tot ongeveer 4 voor glycocholzuur, en ongeveer 2 voor taurocholzuur. Dit maakt dat geconjugeerde galzuren in een breder pH-bereik worden geïoniseerd om de overeenkomstige zouten te vormen.
De hydrofiel van het gewone zuur en de galzouten neemt af in de volgende volgorde: glycinegeconjugeerd < taurinegeconjugeerd < lithocholzuur < deoxycholzuur < chenodeoxycholzuur < cholzuur <ursodeoxycholzuur.
Ten slotte vermindert conjugatie ook de cytotoxiciteit van primaire galzuren.
Secondaire galzuren worden gevormd uit primaire galzuren die niet uit de dunne darm zijn geresorbeerd. Zodra zij de dikke darm bereiken, kunnen zij door de darmmicrobiota verschillende modificaties ondergaan om secundaire galzuren te vormen (zie hieronder). Zij vormen de resterende 20% van de galzurenpool van het lichaam.
Een andere manier om galzouten te categoriseren is gebaseerd op hun conjugatie met glycine en taurine en hun mate van hydroxylering. Op deze basis worden drie categorieën onderscheiden.
- Trihydroxy conjugaten, zoals taurocholzuur en glycocholzuur.
- Dihydroxy conjugaten, zoals glycodeoxycholzuur, glycochenodeoxycholzuur, taurochenodeoxycholzuur, en taurodeoxycholzuur. Zij maken ongeveer 60% uit van de in de gal aanwezige galzouten.
- Ongeconjugeerde vormen, zoals cholzuur, deoxycholzuur, chenodeoxycholzuur, en lithocholzuur.
Functie van galzuren
Al hun fysiologische functies worden uitgevoerd in de geconjugeerde vorm.
- Zij vormen de belangrijkste route voor de eliminatie van cholesterol uit het menselijk lichaam.
De mens heeft namelijk niet de enzymen om de cyclohexaanringen of de cyclopentaanring van de steroïdenkern open te breken, noch om cholesterol te oxideren tot CO2 en water.
Het andere mechanisme om de steroïden uit het lichaam te elimineren is als cholesterol op zich in de gal. - Bile zouten zijn sterke oppervlakte-actieve stoffen. En in het bijzonder zijn di- en trihydroxyconjugaten de beste oppervlakte-actieve stoffen onder de galzuren, veel effectiever dan ongeconjugeerde tegenhangers, omdat zij meer polaire groepen hebben.
Eenmaal in contact met apolaire lipiden in het lumen van de dunne darm, interageert het convexe apolaire oppervlak met de apolaire lipiden, zoals triglyceriden, cholesterolesters en esters van vetoplosbare vitaminen, terwijl het concave polaire oppervlak interageert met het omringende waterige medium. Dit verhoogt de dispersie van apolaire lipiden in het waterige medium, aangezien het de vorming van kleine lipidedruppeltjes mogelijk maakt, waardoor het oppervlak wordt vergroot voor:
lipase-activiteit, voornamelijk pancreaslipase, (galzouten spelen ook een directe rol bij de activering van dit enzym);
darmesterase-activiteit.
Daarna vergemakkelijken zij de absorptie van de producten van de vetvertering, alsmede van de in vet oplosbare vitaminen door het darmslijmvlies, dank zij de vorming van gemengde micellen.
De galzuren vervullen een soortgelijke functie in de galblaas, waar zij, door de vorming van gemengde micellen met fosfolipiden, het neerslaan van cholesterol verhinderen.
Notitie: Als gevolg van de rangschikking van polaire en apolaire groepen vormen galzuren in waterige oplossing micellen, gewoonlijk bestaande uit minder dan 10 monomeren, zolang hun concentratie boven de zogenaamde kritische micellaire concentratie of CMC ligt.
- Op darmniveau moduleren zij de secretie van pancreasenzymen en cholecystokinine.
- In de dunne en dikke darm hebben zij een krachtige antimicrobiële activiteit, voornamelijk deoxycholzuur, in het bijzonder tegen Gram-positieve bacteriën. Deze activiteit kan het gevolg zijn van oxidatieve DNA-beschadiging, en/of van beschadiging van het celmembraan. Daarom spelen zij een belangrijke rol bij de preventie van bacteriële overgroei, maar ook bij de regulering van de samenstelling van de darmmicrobiota.
- De laatste jaren wordt duidelijk dat zij een regulerende rol spelen bij de controle van het energiemetabolisme, en in het bijzonder bij de leverglucosehuishouding.
Enterohepatische circulatie van galzouten
Na vetopname, scheiden enteroendocriene cellen van de twaalfvingerige darm cholecystokinine af in de bloedstroom. De binding van het hormoon aan receptoren op gladde spiercellen van de galblaas bevordert hun samentrekking; het hormoon veroorzaakt ook de ontspanning van de sluitspier van Oddi. Dit alles resulteert in de afscheiding van de gal, en dus van galzuren in de twaalfvingerige darm.
Onder fysiologische omstandigheden is de galzoutenpool van de mens constant, en gelijk aan ongeveer 3-5 g. Dit wordt mogelijk gemaakt door twee processen:
- de intestinale reabsorptie ervan;
- de de novo synthese ervan (zie hieronder).
Tot 95% van de uitgescheiden galzouten wordt weer uit de darm opgenomen, niet samen met de produkten van de vetvertering, maar via een proces dat enterohepatische circulatie wordt genoemd.
Het is een uiterst efficiënt recyclingsysteem, dat tenminste twee maal per maaltijd schijnt plaats te vinden, en dat de lever, de galboom, de dunne darm, de dikke darm en de portale circulatie omvat, via welke de gereabsorbeerde moleculen naar de lever terugkeren. Deze recirculatie is noodzakelijk omdat de capaciteit van de lever om galzuren te synthetiseren beperkt is en onvoldoende om aan de intestinale behoeften te voldoen indien de galzouten in grote hoeveelheden in de feces zouden worden uitgescheiden.
De meeste galzouten worden geherabsorbeerd in het distale ileum, het onderste deel van de dunne darm, door een natrium-afhankelijke transporteur binnen de borstelgrens van de enterocyten, genaamd natrium-afhankelijke galzuurtransporter of ASBT, die het cotransport van een molecuul galzuur en twee natriumionen uitvoert.
In de enterocyt worden galzuren vermoedelijk over het cytosol naar de basolaterale membraan getransporteerd door het ileale galzuurbindende eiwit of IBABP. Zij passeren de basolaterale membraan door de organische solutentransporter alpha-beta of OSTα/OSTβ, komen in de portale circulatie, en, gebonden aan albumine, bereiken de lever.
Er zij op gewezen dat een klein percentage galzuren de lever bereikt via de leverslagader.
Op hepatisch niveau is hun extractie zeer efficiënt, met een first-pass extractiefractie fractie variërend van 50 tot 90%, een percentage dat afhangt van de galzuurstructuur. De opname van geconjugeerde galzuren wordt hoofdzakelijk gemedieerd door een Na+-afhankelijk actief transportsysteem, namelijk het natriumafhankelijke taurocholaat cotransporting polypeptide of NTCP. Er kan echter ook een natriumonafhankelijke opname plaatsvinden, uitgevoerd door eiwitten van de familie van organische aniontransporterende polypeptiden of OATP, voornamelijk OATP1B1 en OATP1B3.
De snelheidsbeperkende stap in de enterohepatische circulatie is hun canaliculaire secretie, grotendeels gemedieerd door de galzoutexportpomp of BSEP, in een ATP-afhankelijk proces. Deze pomp vervoert monoanionische galzouten, die het talrijkst zijn. Galzuren geconjugeerd met glucuronzuur of sulfaat, die dianionisch zijn, worden getransporteerd door verschillende dragers, zoals MRP2 en BCRP.
Notitie: De serumniveaus van galzuren variëren op basis van de snelheid van hun reabsorptie, en zijn daarom hoger tijdens de maaltijd, wanneer de enterohepatische circulatie actiever is.
Intestinaal metabolisme van galzuren
De galzuren die aan de ileale absorptie ontsnappen, komen in het colon terecht, waar zij gedeeltelijk door de intestinale microbiota worden gemodificeerd en in secundaire galzuren worden omgezet.
De voornaamste reacties worden hieronder opgesomd.
- Deconjugatie
Op de zijketen kan hydrolyse van de C24 N-acyl amide binding optreden, waarbij niet-geconjugeerde galzuren en glycine of taurine vrijkomen. Deze reactie wordt gekatalyseerd door bacteriële hydrolasen die zowel in de dunne darm als in het colon aanwezig zijn. - 7α-Dehydroxylering
Kwantitatief is dit de belangrijkste reactie, die wordt uitgevoerd door colonale bacteriële dehydratasen die de hydroxylgroep op positie 7 verwijderen om 7-deoxy galzuren te vormen. Met name wordt deoxycholzuur gevormd uit cholzuur, en lithocholzuur, een giftig secundair galzuur, uit chenodeoxycholzuur.
Opgemerkt zij dat 7α-dehydroxylering, in tegenstelling tot oxidatie en epimerisatie (zie hieronder), alleen kan plaatsvinden op niet-geconjugeerde galzuren, en dat deconjugering derhalve een essentiële voorwaarde is. - Oxidatie en epimerisatie
Het zijn reacties waarbij de hydroxylgroepen op de posities 3, 7 en 12 betrokken zijn en die gekatalyseerd worden door bacteriële hydroxysteroïde dehydrogenases. Zo is ursodeoxycholzuur het resultaat van de epimerisatie van chenodeoxycholzuur.
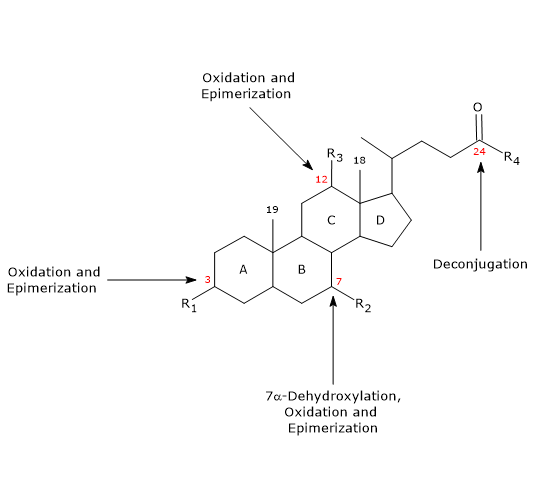
Enkele van de secundaire galzuren worden vervolgens uit het colon geabsorbeerd en keren terug naar de lever. In de hepatocyten worden ze, indien nodig, gereconjugeerd en opnieuw uitgescheiden. Zij die niet worden gereabsorbeerd, worden in de feces uitgescheiden.
Waar oxidaties en deconjugaties worden uitgevoerd door een breed spectrum van anaërobe bacteriën, wordt 7α-dehydroxylatie uitgevoerd door een beperkt aantal anaërobe bacteriën in de dikke darm.
7α-dehydroxyleringen en deconjugaties verhogen de pKa van de galzuren, en daardoor hun hydrofobiciteit, waardoor een zekere mate van passieve absorptie door de wand van het colon mogelijk wordt.
De toename van de hydrofobiciteit gaat ook gepaard met een verhoogde toxiciteit van deze moleculen. En een hoge concentratie van secundaire galzuren in de gal, het bloed en de feces is in verband gebracht met de pathogenese van darmkanker.
Oplosbare vezels en reabsorptie van galzouten
De reabsorptie van galzouten kan worden verminderd door de chelerende werking van oplosbare vezels, zoals die in vers fruit, peulvruchten, haver en haverzemelen voorkomen, die deze binden, waardoor de opname ervan wordt verminderd. Dit verhoogt op zijn beurt de de novo synthese van galzuren, waarbij de expressie van 7α-hydroxylase en sterol 12α-hydroxylase (zie hieronder) wordt verhoogd, en verlaagt daardoor de cholesterolconcentratie in de hepatocyten.
De verlaging van het levercholesterol verhoogt de expressie van de LDL-receptor, en verlaagt dus de plasmaconcentratie van LDL-cholesterol. Anderzijds stimuleert het ook de synthese van HMG-CoA-reductase, het sleutelenzym in de biosynthese van cholesterol.
Noot: Sommige anti-cholesterolmiddelen werken door galzuren in de darm te binden, waardoor de reabsorptie ervan wordt verhinderd.
Synthese van primaire galzuren
Kwantitatief zijn galzuren het belangrijkste product van het cholesterolmetabolisme.
Zoals eerder gezegd, houden de enterohepatische circulatie en hun de novo synthese een constante omvang van de galzurenpool. In het bijzonder maakt de de novo synthese de vervanging mogelijk van galzouten die in het gezicht worden uitgescheiden, ongeveer 5-10% van de lichaamspool, namelijk ~ 0,5 g/dag.
Hieronder wordt de synthese beschreven van cholzuur en chenodeoxycholzuur, en hun conjugatie met de aminozuren taurine en glycine.
Er zijn twee hoofdroutes voor de synthese van galzuren: de klassieke route en de alternatieve route. Daarnaast zullen ook enkele andere minder belangrijke routes worden beschreven.
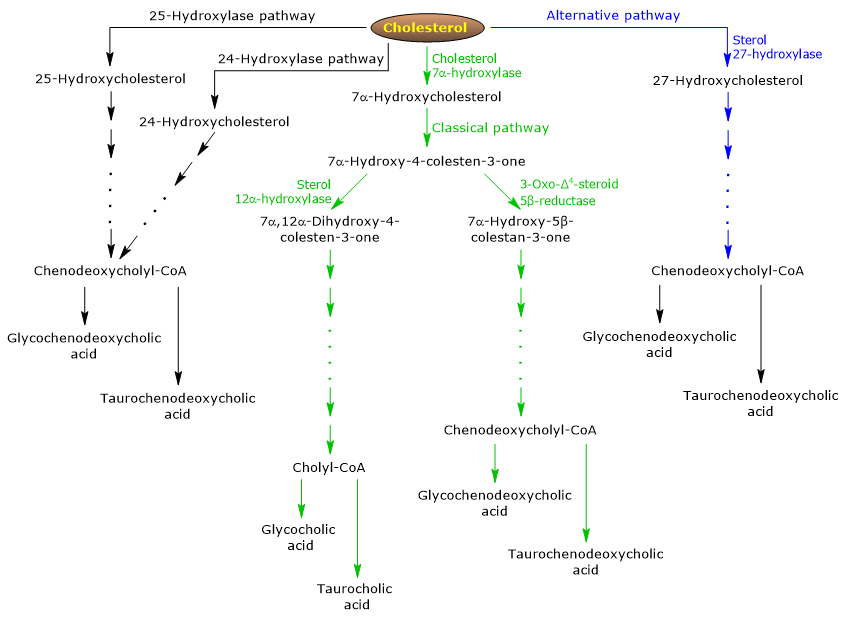
De klassieke of neutrale route
Bij de mens wordt tot 90% van de galzouten geproduceerd via de klassieke route (zie fig. 5), ook wel de “neutrale” route genoemd omdat de tussenproducten neutrale moleculen zijn.
Het is een stofwisselingsroute die alleen in de lever voorkomt, die bestaat uit reacties die worden gekatalyseerd door enzymen die gelokaliseerd zijn in het cytosol, het endoplasmatisch reticulum, de peroxisomen en de mitochondriën, en waarvan de eindproducten de conjugaten zijn van cholzuur en chenodeoxycholzuur.
- De eerste reactie is de hydroxylering op positie 7 van cholesterol, om 7α-hydroxycholesterol te vormen. De reactie wordt gekatalyseerd door cholesterol 7α-hydroxylase of CYP7A1 (E.C. 1.14.14.23). Dit enzym is gelokaliseerd in het endoplasmatisch reticulum en katalyseert de snelheidsbeperkende stap van deze route.
Cholesterol + NADPH + H+ + O2 → 7α-Hydroxycholesterol + NADP+ + H2O
- 7α-Hydroxycholesterol ondergaat oxidatie van de 3β-hydroxylgroep en verschuiving van de dubbele binding van de 5,6-positie naar de 4,5-positie, zodat 7α-hydroxy-4-cholesten-3-one ontstaat. De reactie wordt gekatalyseerd door 3β-hydroxy-Δ5-C27-steroïd oxidoreductase of HSD3B7 (E.C. 1.1.1.181), een enzym dat gelokaliseerd is in het endoplasmatisch reticulum.
- 7α-Hydroxy-4-cholesten-3-on kan twee routes volgen:
om in de route te komen die leidt tot de synthese van cholzuur, via de reactie die wordt gekatalyseerd door 7α-hydroxy-4-cholesten-3-on 12α-monooxygenase of sterol 12α-hydroxylase of CYP8B1 (E.C. 1.14.18.8), een enzym dat gelokaliseerd is in het endoplasmatisch reticulum;
om de route in te gaan die leidt tot de synthese van chenodeoxycholzuur, via de reactie die gekatalyseerd wordt door 3-oxo-Δ4-steroïde 5β-reductase of AKR1D1 (E.C. 1.3.1.3), een cytosolisch enzym.
Het moet worden onderstreept dat de activiteit van sterol 12α-hydroxylase bepalend is voor de verhouding tussen cholzuur en chenodeoxycholzuur, en uiteindelijk voor de detergerende capaciteit van de galzuurpool. En in feite is de regulering van sterol 12α-hydroxylase-gen-transcriptie een van de belangrijkste regulerende stappen van de klassieke route.
Daaruit volgt, dat als 7α-hydroxy-4-cholesten-3-on via de door sterol 12α-hydroxylase gekatalyseerde reactie verloopt, de volgende reacties zullen optreden.
- 7α-hydroxy-4-cholesten-3-on wordt op positie 12 gehydroxyleerd door sterol 12α-hydroxylase, tot 7α,12α-dihydroxy-4-cholesten-3-on.
- 7α,12α-dihydroxy-4-cholesten-3-on ondergaat reductie van de dubbele binding op positie 4,5, in de reactie die wordt gekatalyseerd door 3-oxo-Δ4-steroïde 5β-reductase, om 5β-cholestan-7α,12α-diol-3-on te vormen.
- 5β-Cholestan-7α,12α-diol-3-on ondergaat reductie van de hydroxylgroep op positie 4, in de reactie die wordt gekatalyseerd door 3α-hydroxysteroïd-dehydrogenase of AKR1C4 (EC 1.1.1.213), een cytosolisch enzym, tot 5β-cholestan-3α,7α,12α-triol.
- 5β-Cholestan-3α,7α,12α-triol ondergaat oxidatie van de zijketen via drie reacties die worden gekatalyseerd door sterol 27-hydroxylase of CYP27A1 (EC 1.14.15.15). Het is een mitochondriaal enzym dat ook aanwezig is in extrahepatische weefsels en macrofagen en dat een hydroxylgroep op positie 27 introduceert. De hydroxylgroep wordt geoxideerd tot aldehyde, en vervolgens tot carboxylzuur, om 3α,7α,12α-trihydroxy-5β-cholestaanzuur te vormen.
- 3α,7α,12α-trihydroxy-5β-cholestaanzuur wordt geactiveerd tot zijn co-enzym A ester, 3α,7α,12α-trihydroxy-5β-cholestanoyl-CoA, in de reactie gekatalyseerd door ofwel very long chain acyl-CoA synthetase of VLCS (EC 6.2.1.-), of galzuur-CoA synthetase of BACS (EC 6.2.1.7), die beide in het endoplasmatisch reticulum gelokaliseerd zijn.
- 3α,7α,12α-Trihydroxy-5β-cholestanoyl-CoA wordt naar peroxisomen getransporteerd, waar het vijf opeenvolgende reacties ondergaat, die elk door een ander enzym gekatalyseerd worden. In de laatste twee reacties wordt de zijketen ingekort tot vier koolstofatomen, en uiteindelijk wordt cholyl-CoA gevormd.
- In de laatste stap vindt de conjugatie plaats, via een amidebinding, van de carbonzuurgroep van de zijketen met het aminozuur glycine of taurine. De reactie wordt gekatalyseerd door galzuur-CoA:aminozuur N-acyltransferase of BAAT (EC 2.3.1.65), dat hoofdzakelijk gelokaliseerd is in peroxisomen.
De reactieprodukten zijn dus de geconjugeerde galzuren: glycocholzuur en taurocholzuur.
Als 7α-hydroxy-4-cholesten-3-on niet via de door sterol 12α-hydroxylase gekatalyseerde reactie verloopt, komt het in de route die leidt tot de synthese van chenodeoxycholzuur-conjugaten, via de hieronder beschreven reacties.
- 7α-Hydroxy-4-cholesten-3-on wordt omgezet in 7α-hydroxy-5β-cholestan-3-on in de reactie die wordt gekatalyseerd door 3-oxo-Δ4-steroïde 5β-reductase.
- 7α-Hydroxy-5β-cholestan-3-on wordt omgezet in 5β-cholestan-3α,7α-diol in de reactie die wordt gekatalyseerd door 3α-hydroxysteroïde dehydrogenase.
Daarna worden de geconjugeerde galzuren glycochenodeoxycholzuur en taurochenodeoxycholzuur gevormd door modificaties die vergelijkbaar zijn met die bij de conjugatie van cholzuur, en grotendeels door dezelfde enzymen gekatalyseerd worden.
Opmerking: Niet-geconjugeerde galzuren die in de darm worden gevormd, moeten de lever bereiken om opnieuw te worden geconjugeerd.
De alternatieve of zure route
Deze komt het meest voor bij de foetus en de pasgeborene, terwijl zij bij volwassenen leidt tot de synthese van minder dan 10% van de galzouten.
Deze route (zie fig. 5) verschilt van de klassieke route doordat:
- de tussenproducten zure moleculen zijn, waarvan de alternatieve naam “zure route” afkomstig is;
- de oxidatie van de zijketen wordt gevolgd door modificaties van de steroïdenkern, en niet omgekeerd;
- de eindproducten zijn conjugaten van chenodeoxycholzuur.
De eerste stap omvat de omzetting van cholesterol in 27-hydroxycholesterol in de reactie die wordt gekatalyseerd door sterol 27-hydroxylase.
27-Hydroxycholesterol kan twee routes volgen.
Route A
- 27-hydroxycholesterol wordt omgezet in 3β-hydroxy-5-cholestenoëzuur in een reactie die wordt gekatalyseerd door sterol 27-hydroxylase.
- 3β-hydroxy-5-cholestenoëzuur wordt op positie 7 gehydroxyleerd in een reactie die wordt gekatalyseerd door oxysterol 7α-hydroxylase of CYP7B1 (EC 1.14.13.100), een enzym dat in het endoplasmatisch reticulum is gelokaliseerd, om 3β-7α-dihydroxy-5-colestenoëzuur te vormen.
- 3β-7α-dihydroxy-5-cholestenoic acid wordt omgezet in 3-oxo-7α-hydroxy-4-cholestenoic acid, in de reactie gekatalyseerd door 3β-hydroxy-Δ5-C27-steroid oxidoreductase.
- 3-Oxo-7α-hydroxy-4-cholestenoic acid, as a result of side chain modifications, forms chenodeoxycholic acid, and then its conjugates.
Route B
- 27-Hydroxycholesterol wordt omgezet in 7α,27-dihydroxycholesterol in de reactie gekatalyseerd door oxysterol 7α-hydroxylase en cholesterol 7α-hydroxylase.
- 7α,27-dihydroxycholesterol wordt omgezet in 7α,26-dihydroxy-4-cholesten-3-on in de reactie die gekatalyseerd wordt door 3β-hydroxy-Δ5-C27-steroïde oxidoreductase;
7α,26-dihydroxy-4-cholesten-3-on kan rechtstreeks worden omgezet in conjugaten van chenodeoxycholzuur, of kan worden omgezet in 3-oxo-7α-hydroxy-4-colestenoic acid, en ondergaat dan zijketenmodificaties en andere reacties die leiden tot de synthese van de conjugaten van chenodeoxycholzuur.
Minor pathways
Er zijn ook minor pathways (zie fig. 5) die bijdragen tot de galzoutsynthese, zij het in mindere mate dan de klassieke en alternatieve pathways.
Bijv.:
- Een cholesterol 25-hydroxylase (EC 1.14.99.38) komt tot expressie in de lever.
- Een cholesterol 24-hydroxylase of CYP46A1 (EC 1.14.14.25) komt tot expressie in de hersenen, en daarom, hoewel dit orgaan geen cholesterol kan exporteren, exporteert het oxysterolen.
- Een niet-specifiek 7α-hydroxylase is ook ontdekt. Het komt tot expressie in alle weefsels en lijkt betrokken te zijn bij de aanmaak van oxysterolen, die naar de hepatocyten kunnen worden getransporteerd om te worden omgezet in chenodeoxycholzuur.
Daarnaast komt sterol 27-hydroxylase tot expressie in verschillende weefsels, en daarom moeten zijn reactieproducten naar de lever worden getransporteerd om te worden omgezet in galzouten.
Galzouten: regulering van de synthese
Regulatie van de galzuursynthese vindt plaats via een negatief terugkoppelingsmechanisme, met name op de expressie van cholesterol 7α-hydroxylase en sterol 12α-hydroxylase.
Bij een overmaat aan galzuren, zowel vrije als geconjugeerde, binden deze moleculen zich aan de nucleaire receptor farnesoïde X-receptor of FRX, waardoor deze wordt geactiveerd: het meest werkzame galzuur is chenodeoxycholzuur, terwijl andere, zoals ursodeoxycholzuur, deze niet activeren.
FRX induceert de expressie van de transcriptionele repressor small heterodimer partner of SHP, die op zijn beurt interageert met andere transcriptiefactoren, zoals liver receptor homolog-1 of LRH-1, en hepatocyte nuclear factor-4α of HNF-4α. Deze transcriptiefactoren binden zich aan een sequentie in de promotorregio van 7α-hydroxylase- en 12α-hydroxylase-genen, regio genoemd galzuurresponselementen of BARE’s, waardoor hun transcriptie wordt geremd.
Een van de redenen waarom de galzoutsynthese strak wordt gereguleerd, is dat veel van hun metabolieten toxisch zijn.
Chiang J.Y.L. Bile acids: regulation of synthesis. J Lipid Res 2009;50(10):1955-66. doi:10.1194/jlr.R900010-JLR200
Gropper S.S., Smith J.L. Advanced nutrition and human metabolism. 6h Edition. Cengage Learning, 2012
Moghimipour E., Ameri A., and Handali S. Absorptie-verhogende effecten van galzouten. Molecules 2015;20(8); 14451-73. doi:10.3390/molecules200814451
Monte M.J., Marin J.J.G., Antelo A., Vazquez-Tato J. Bile acids: Chemistry, physiology, and pathophysiology. World J Gastroenterol 2009;15(7):804-16. doi:10.3748/wjg.15.804
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal M.D., Glew R.H. Medical biochemistry – Human metabolism in health and disease. John Wiley J. & Sons, Inc., Publication, 2009
Sundaram S.S., Bove K.E., Lovell M.A. and Sokol R.J. Mechanisms of Disease: inborn errors of bile acid synthesis. Nat Clin Pract Gastroenterol Hepatol 2008;5(8):456-68. doi:10.1038/ncpgasthep1179