ABSTRACT: Dostępne leki antyretrowirusowe (ARV) w leczeniu HIV rozszerzyły się od 2018 roku. Zatwierdzono nowe typy leków ARV o nowych mechanizmach działania, w tym ibalizumab-uiyk i fostemsavir. Pojawiły się również zatwierdzenia tabletek łączonych wcześniej dostępnych leków, takich jak bictegravir/emtricitabine/tenofovir alafenamide i dolutegravir/lamivudine. Wreszcie, nastąpiło rozszerzenie zatwierdzonych wskazań dla wcześniej dostępnych samych leków ARV, takich jak emtricitabine/tenofovir alafenamide do stosowania w profilaktyce przedekspozycyjnej.
US Pharm. 2020:45(10):17-25.
Główne filary środków antyretrowirusowych (ARV) w leczeniu HIV w dużej mierze składały się z tej samej garstki klas leków przez lata. Leczenie HIV po raz pierwszy próbowano zastosować nukleozydowe inhibitory odwrotnej transkryptazy (NRTI), pierwszą zatwierdzoną przez FDA klasę leków antyretrowirusowych. Stopniowo odkrywano coraz więcej klas i udostępniano je do leczenia w różnych, często złożonych, schematach (TABELA 1).1-3 Po zatwierdzeniu raltegrawiru w 2007 r., nowe zatwierdzenia leków na HIV dotyczyły w dużej mierze przeprojektowanych dostępnych leków i nowych leków skojarzonych. Zmieniło się to w 2018 roku wraz z zatwierdzeniem ibalizumabu-uiyk, pierwszego nowego ARV od ponad dekady.4 Po ibalizumabie-uiyk szybko pojawił się nowy nienukleozydowy inhibitor odwrotnej transkryptazy (NNRTI), dorawiryna, później w tym samym roku, a nowy inhibitor przywiązania, fostemsavir, w 2020 roku (TABELA 2).5-7
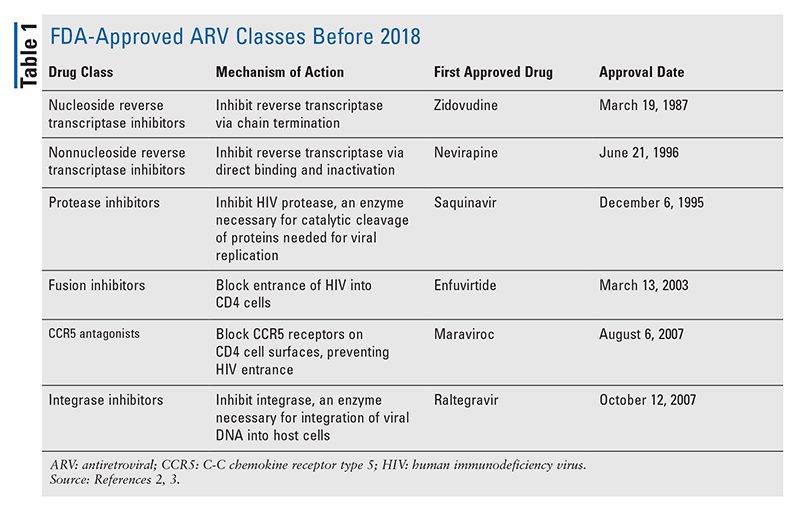
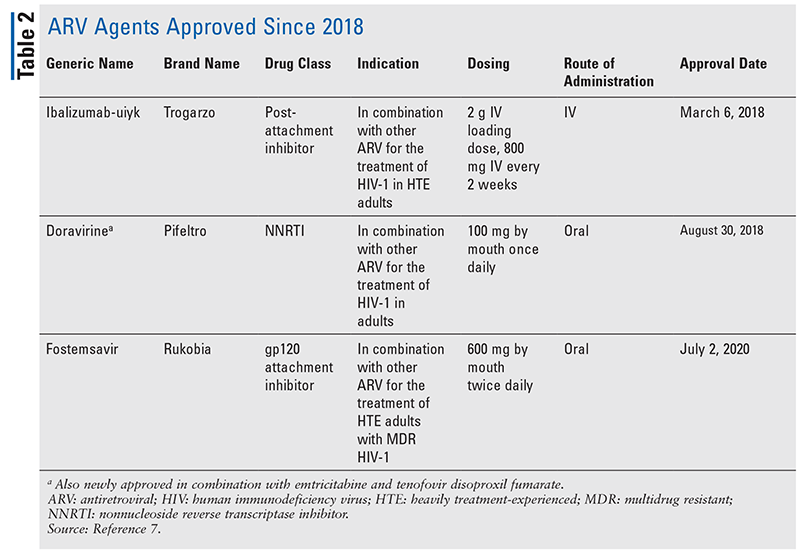
Chociaż nowe leki są często najbardziej ekscytującymi nowymi zatwierdzeniami leków, leki ARV poprawiły się na inne sposoby. Biorąc pod uwagę ogromne obciążenie pigułkami w wielu schematach leczenia HIV, nowo zatwierdzone skojarzone leki przeciwretrowirusowe (TABELA 3) mogą znacznie ułatwić życie pacjentom. Stosowanie takich środków i ograniczanie niezbędnego obciążenia pigułkami wykazało poprawę przestrzegania zaleceń i ogólnych wyników.8,9 Nastąpiło również rozszerzenie zatwierdzonych wskazań dla wcześniej dostępnych leków ARV (TABELA 4), oferując nowe opcje dla niektórych populacji pacjentów i wskazań.10-14
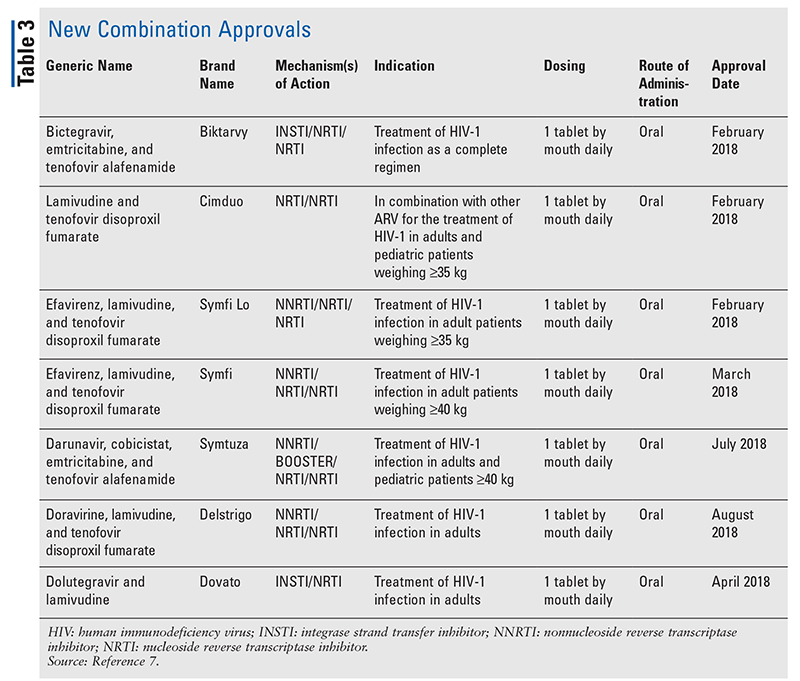
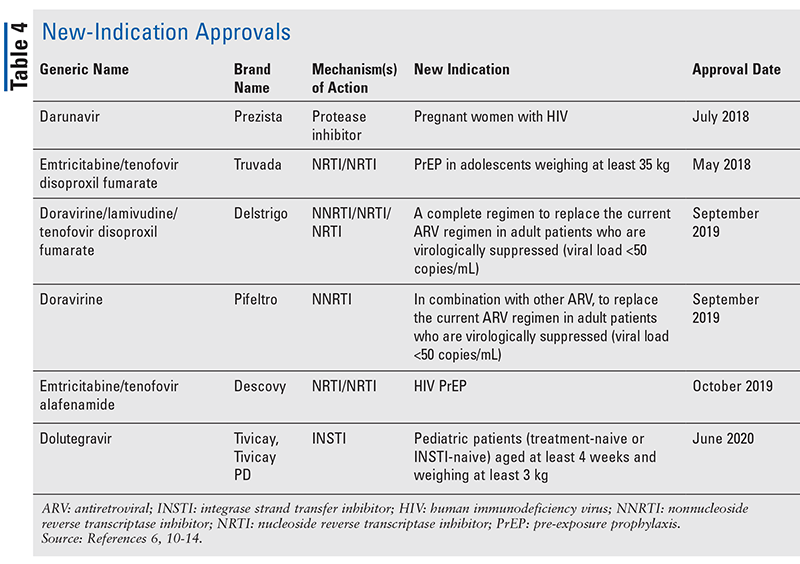
Chociaż istnieje wiele nowych zatwierdzeń od 2018 roku, ten artykuł profiluje cztery z nowo zatwierdzonych leków i jedno nowe wskazanie. Te zatwierdzenia zostały wybrane, aby zademonstrować próbkę szerokiej gamy nowych środków, które stają się dostępne, a także podkreślić niektóre nowe opcje, które oferują wyjątkową możliwość w leczeniu HIV.
Ibalizumab-Uiyk (Trogarzo)
Ibalizumab-uiyk jest wstrzykiwanym rekombinowanym przeciwciałem monoklonalnym, które wiąże się z białkami powierzchniowymi komórek CD4, prowadząc do zmian konformacyjnych, które zapobiegają etapom postattachment wymaganym do fuzji HIV-1 i wejścia do komórki. Jest to jedyny lek monoklonalny stosowany w leczeniu HIV. Ze względu na wyjątkową swoistość wiązania, ibalizumab-uiyk blokuje wnikanie wirusa bez wywoływania immunosupresji, co jest problemem w przypadku wielu leków monoklonalnych.4,15 Jest on wskazany do stosowania w skojarzeniu z innymi lekami antyretrowirusowymi w leczeniu osób dorosłych w ciężkim okresie leczenia (HTE) z HIV-1 opornym na wiele leków (MDR), u których zawodzi dotychczasowy schemat terapii antyretrowirusowej.4
Zatwierdzenie ibalizumabu-uiyk było oparte na badaniu przeprowadzonym u 40 pacjentów HTE z HIV z wiremią większą niż 1000 kopii/mL i udokumentowaną opornością na co najmniej jeden NRTI, NNRTI i inhibitor proteazy. Od pacjentów wymagano również co najmniej 6-miesięcznego leczenia i niedawnego niepowodzenia terapii. Badanie obejmowało trzy okresy, począwszy od 6-dniowego okresu, w którym ustalono i potwierdzono wyjściową wiremię (okres kontrolny). W 7. dniu pacjenci otrzymali dawkę obciążającą 2000 mg ibalizumabu-uiyk jako dodatek do standardowego schematu ART (okres monoterapii funkcjonalnej). W 14. dniu ponownie oceniano wiremię oraz monitorowano i dostosowywano schematy leczenia w celu zapewnienia odpowiedniego działania przeciw zakażeniu HIV. Ibalizumab-uiyk w dawce 800 mg podawano dożylnie co 2 tygodnie aż do zakończenia badania (okres podtrzymujący). Pierwszorzędowy punkt końcowy oceniał różnicę w odsetku zmniejszenia wiremii z okresu kontrolnego do okresu monoterapii funkcjonalnej, w szczególności porównując odsetek pacjentów ze zmniejszeniem całkowitej wiremii o ³0,5 log10. W okresie kontrolnym taki spadek stwierdzono u 3% pacjentów, podczas gdy w okresie monoterapii funkcjonalnej 83% pacjentów osiągnęło deklarowany spadek wiremii. Pod koniec 25 tygodnia u 43% pacjentów osiągnięto wiremię <50 kopii/ml.16
Na podstawie tego badania zatwierdzone dawkowanie ibalizumabu-uiyk to jednorazowa dożylna dawka dożylna 2000 mg, a następnie dożylna dawka podtrzymująca 800 mg co 2 tygodnie.4,16 Wymagane jest uważne monitorowanie przez 1 godzinę po podaniu pierwszego wlewu w celu wykrycia reakcji związanych z wlewem, przy czym monitorowanie kolejnych wlewów zmniejsza się do 15 minut po tolerowaniu dawki początkowej.4 Ibalizumab-uiyk wydaje się być poza tym dobrze tolerowany; najczęstszymi działaniami niepożądanymi związanymi ze stosowaniem ibalizumabu-uiyk były nudności, zawroty głowy i biegunka.4,16
Fostemsavir (Rukobia)
Fostemsavir jest nowym lekiem przeciwretrowirusowym wskazanym do stosowania w terapii skojarzonej u osób dorosłych z HTE, u których stwierdzono występowanie MDR HIV-1, szczególnie u pacjentów, u których nie powiodła się dotychczasowa ART ze względu na potencjalną oporność, nietolerancję lub względy bezpieczeństwa.4 Jest to pierwszy zatwierdzony przez FDA inhibitor przyłączania. Po aktywacji enzymatycznej do aktywnej cząsteczki temsaviru, wiąże się on z gp120, glikoproteiną otoczki wirusa niezbędną do przyłączenia się wirusa do komórek CD4. Zapobiega to wnikaniu wirusa do komórek CD4, skutecznie zatrzymując replikację wirusa. Ze względu na ten nowatorski mechanizm jest mało prawdopodobne, aby fostemsawir indukował oporność na siebie poprzez presję selektywną związaną z większością innych leków antyretrowirusowych.6,17
Fostemsawir oceniano zarówno pod względem bezpieczeństwa, jak i skuteczności w randomizowanym, podwójnie zaślepionym, kontrolowanym placebo badaniu klinicznym (BRIGHTE) obejmującym 371 pacjentów z HTE HIV-1.16,17 Pacjenci w głównej kohorcie byli leczeni zarówno wyjściowym schematem ART, jak i fostemsawirem w dawce 600 mg dwa razy na dobę lub placebo przez łącznie 8 dni. Po ocenie w dniu 8, pacjenci leczeni fostemsawirem wykazywali znacząco niższe poziomy wirusowego HIV-RNA w surowicy. Po tym początkowym okresie leczenia, wszyscy pacjenci zostali przestawieni na fostemsavir 600 mg dwa razy na dobę. W 24 tygodniu 53% uczestników badania osiągnęło skuteczny, niewykrywalny poziom supresji wirusa, przy czym w 96 tygodniu supresja wzrosła do 60%.17,18
Najczęściej zgłaszanym działaniem niepożądanym fostemsawiru były nudności. Cięższe reakcje, w tym zwiększenie aktywności enzymów wątrobowych, zgłaszano u pacjentów ze współzakażeniem wirusem zapalenia wątroby typu B lub C.17,18 W innych badaniach zgłaszano niewielką częstość występowania bólu głowy, wysypki i biegunki. Aktywny metabolit temsawiru jest metabolizowany przez CYP3A4, dlatego należy unikać silnych induktorów, takich jak karbamazepina, ryfampina i ziele dziurawca, aby zapobiec zmniejszeniu stężenia temsawiru w surowicy.17-19
Bictegravir/Emtricitabine/TenofovirAlafenamide (Biktarvy)
Bictegravir/emtricitabine/tenofovir alafenamide (BIC/FTC/TAF) jest tabletką złożoną o stałej dawce, podawaną raz na dobę, zawierającą nowy inhibitor integrazy i dwa nukleozydowe/nukleotydowe inhibitory odwrotnej transkryptazy. Poszczególne składniki preparatu Biktarvy to: bictegravir 50 mg (inhibitor transferu nici integrazy), emtricitabina 200 mg (NRTI) i alafenamid tenofowiru 25 mg (NRTI). BIC/FTC/TAF jest wskazany jako kompletny schemat leczenia u osób dorosłych zakażonych HIV-1 bez wcześniejszej ART lub w celu zastąpienia obecnego schematu ART u pacjentów, u których występuje supresja wirusologiczna (wiremia 50 kopii na ml), stosujących stabilny schemat ARV przez co najmniej 3 miesiące i u których nie wystąpiło niepowodzenie leczenia lub oporność na poszczególne składniki. Co najważniejsze, jest to kompletny schemat w postaci jednej tabletki, niewymagający stosowania innych leków antyretrowirusowych.20
BIC/FTC/TAF został zatwierdzony w 2018 r. po przeprowadzeniu czterech badań klinicznych. W dwóch z badań klinicznych testowano skuteczność i bezpieczeństwo stosowania BIC/FTC/TAF u pacjentów bez historii ART: Badanie 1489 (randomizowane, BIC/FTC/TAF vs. abakawir/ dolutegrawir/lamiwudyna oraz Badanie 1490 (randomizowane, BIC/FTC/TAF vs. dolutegrawir + emtricitabina/tenofowir alafenamid ).21,22 W badaniu 1489, pierwszorzędowy punkt końcowy wiremii <50 kopii/ml osiągnięto w 92% w grupie BIC/FTC/TAF i 93% w grupie ABC/DTG/3TC (różnica w leczeniu -0,6%; 95% przedział ufności , -4,8% do 3,6%). W badaniu 1490 pierwszorzędowy punkt końcowy wiremii <50 kopii/ml osiągnięto w 89% w grupie BIC/FTC/TAF i 93% w grupie DTG + FTC/TAF (różnica w leczeniu -3,5%; 95% CI, -7,9% do 1,0%).21,22
W pozostałych dwóch badaniach badano skuteczność i bezpieczeństwo stosowania BIC/FTC/TAF u pacjentów z supresją wirusologiczną, którzy mieliby zostać przestawieni z dotychczas stosowanych schematów ART na BIC/FTC/TAF: Badanie 1844 (randomizowane, zamiana dolutegrawiru plus abakawir/lamiwudyna lub ABC/DTG/3TC na BIC/FTC/TAF) oraz badanie 1878 (otwarte, zamiana atazanawiru lub darunawiru ze wzmocnieniem plus abakawir/emtricytabina lub emtricytabina/fumaran tenofowiru dizoproksylu na BIC/FTC/TAF).23,24 W badaniu 1844, pierwszorzędowy punkt końcowy pacjentów, którzy utracili stan supresji wirusologicznej (wiremia ³50 kopii na ml) wystąpił u 1% pacjentów z grupy BIC/FTC/TAF i <1% pacjentów z grupy stosującej oryginalny schemat (różnica w leczeniu 0,7%, 95% CI, -1,0% do 2,8%). W badaniu 1878 pierwszorzędowy punkt końcowy w postaci pacjentów, którzy utracili status supresji wirusologicznej, wystąpił u 2% pacjentów z grupy otrzymującej BIC/FTC/TAF i u 2% pacjentów z grupy otrzymującej oryginalny schemat (różnica w leczeniu 0,0%; 95% CI, -2,5% do 2,5%).23,24
BIC/FTC/TAF jest podawany doustnie raz na dobę, z jedzeniem lub bez jedzenia. Najczęściej zgłaszanymi działaniami niepożądanymi obserwowanymi u pacjentów były biegunka, nudności i ból głowy.20-24
Dolutegrawir/Lamiwudyna (Dovato)
Kombinacja dolutegrawiru/lamiwudyny (DTG/3TC), INSTI i NRTI, została zatwierdzona w 2019 roku. Jest to pierwszy dwulekowy, kompletny schemat o stałej dawce do leczenia zakażenia HIV-1 u dorosłych pacjentów nienawróconych na leczenie. Kontrastuje to z tradycyjnie wymaganymi trzema lekowymi opcjami schematu standard-of-care. Może to stanowić szansę dla pacjentów, którzy nie mogą tolerować żadnego z częściej stosowanych schematów trójlekowych ze względu na działania niepożądane lub nieuniknione interakcje lekowe.25,26
Skuteczność i bezpieczeństwo połączenia dolutegrawiru/lamiwudyny wykazano w dwóch identycznych badaniach, GEMINI-1 i GEMINI-2.27 Do badań tych włączono łącznie 1433 zakażonych HIV-1, leczonych dorosłych, którzy zostali randomizowani do otrzymywania schematu dwulekowego, dolutegrawir 50 mg plus lamiwudyna 150 mg, lub schematu trójlekowego, dolutegrawir plus emtricitabina plus fumaran tenofowiru dizoproksylu. Pierwszorzędowy punkt końcowy, jakim było osiągnięcie wiremii <50 kopii/ml, wykazał, że DTG/3TC był nie gorszy niż 91% z 716 pacjentów leczonych dwoma lekami i 93% z 717 pacjentów leczonych trzema lekami (różnica w leczeniu wynosiła -1,7%; 95% CI, -4,4% do 1,1%) – gdy wyniki tych dwóch badań połączono razem. W połączonych badaniach wykazano również, że liczbowo mniej pacjentów miało zdarzenia niepożądane związane z lekami w przypadku schematu dwulekowego w porównaniu ze schematem trójlekowym (odpowiednio 126 z 716 i 169 z 717). Ze względu na nie gorszą skuteczność i podobny profil tolerancji, Department of Health and Human Services był w stanie włączyć kombinację DTG/3TC w stałej dawce do wytycznych dotyczących HIV/AIDS jako zalecany schemat początkowy dla większości osób zakażonych wirusem HIV.27
Kombinacja dolutegrawir/lamiwudyna jest podawana raz na dobę doustnie z jedzeniem lub bez jedzenia. Najczęstsze działania niepożądane obserwowane u pacjentów to ból głowy, nudności, biegunka, zmęczenie i bezsenność. Mimo że jest to tabletka złożona z dwóch leków, nie ma potrzeby podawania jej z innymi lekami przeciwretrowirusowymi, ponieważ jest to kompletny schemat terapii.25-27
Emtricitabine/Tenofovir Alafenamide for Pre-exposure Prophylaxis (PrEP)
Od 2012 roku jedyną zatwierdzoną przez FDA opcją dla PrEP było FTC/ TDF.11 Zmieniło się to w 2019 roku wraz z zatwierdzeniem kombinacji emtricitabine/tenofovir alafenamide (FTC/TAF),13 strukturalnie podobnego leku skojarzonego. Jest on obecnie wskazany do stosowania w PrEP u niezakażonych pacjentów z wysokim ryzykiem przeniesienia wirusa HIV poprzez kontakty seksualne. Nie obejmuje to pacjentów narażonych na ryzyko związane z odbywaniem stosunku pochwowego, ponieważ ta populacja nie została jeszcze oceniona.
Zatwierdzenie PrEP opiera się na niedawnym badaniu DISCOVER, randomizowanym badaniu z podwójnie ślepą próbą, w którym porównywano FTC/TAF ze standardowo stosowanym FTC/TDF w celu zmniejszenia ryzyka nabycia zakażenia HIV-1 u mężczyzn i kobiet transgenderowych mających seks z mężczyznami i narażonych na zakażenie HIV-1.7 Badanie przeprowadzono jako randomizowane, prowadzone metodą podwójnie ślepej próby, w grupach równoległych, z minimalnym okresem obserwacji wynoszącym 48 tygodni, przy czym co najmniej 50% uczestników miało 96 tygodni obserwacji po randomizacji. Do badania włączono 5 399 uczestników, których przydzielono losowo w stosunku 1:1 do jednej z grup. Pierwszorzędowym celem badania była ocena częstości występowania zakażeń HIV-1 na 100 osobo-lat. Wśród 2 694 uczestników w ramieniu FTC/TAF zakażenie HIV-1 wystąpiło u 7 pacjentów (0,16/100 osobolat). Wśród 2 693 uczestników w ramieniu FTC/TDF, zakażenie HIV-1 wystąpiło u 15 pacjentów (0,34/100 osobolat). Przypadki te dowodzą, że FTC/TAF był nie gorszy niż FTC/TDF u uczestników badania, którzy byli narażeni na ryzyko zakażenia HIV, i ostatecznie pozwoliły FDA na dodanie PrEP do wskazań dla FTC/TAF.13
Miejsce FTC/TAF w terapii HIV jest prawdopodobnie nadal niejasne. Chociaż znalazł on zastosowanie w innych obszarach leczenia HIV, jego przewaga nad alternatywą w tym przypadku nie została jeszcze ostatecznie określona. Chociaż TAF jest podobny, może oferować mniejszą częstość występowania zmian gęstości kości i zaburzeń czynności nerek, działań niepożądanych związanych z TDF. Różnica ta nie jest jednak dobrze ustalona, a niektóre dane sugerują, że w schematach, które nie zawierają wspomagania farmakokinetycznego, takiego jak kobicystat lub rytonawir, korzyść ta może nie być istotna klinicznie. 27-29
Podsumowanie
Z uwagi na złożoność wirusa HIV i jego potencjał oporności, terapia ARV może szybko stać się uciążliwa dla pacjentów. Od 2018 r. do chwili obecnej społeczność medyczna zaobserwowała szeroką ekspansję zatwierdzonych przez FDA terapii ARV w leczeniu HIV. Terapie te obejmują nowe tabletki łączone o stałej dawce; nowe leki, które działają poprzez inne mechanizmy niż te wcześniej dostępne na rynku; a nawet nowe wskazania dla wcześniej istniejących leków. Te nowe leki już wpłynęły na aktualne wytyczne dotyczące leczenia i mogą pomóc pacjentom żyć dłużej i zdrowiej.
Treść zawarta w tym artykule służy wyłącznie celom informacyjnym. Treść ta nie ma na celu zastąpienia profesjonalnej porady. Poleganie na jakichkolwiek informacjach podanych w tym artykule odbywa się wyłącznie na własne ryzyko.
1. Vella S, Schwartländer B, Sow SP, et al. The history of antiretroviral therapy and of its implementation in resource-limited areas of the world. AIDS. 2012;26(10):1231-1241.
2. Arts EJ, Hazuda DJ. HIV-1 antiretroviral drug therapy. Cold Spring Harb Perspect Med. 2012;2(4):a007161.
3. Chaudhuri S, Symons JA, Deval J. Innowacje i trendy w rozwoju i zatwierdzaniu leków przeciwwirusowych: 1987-2017 i dalej. Antiviral Res. 2018;155:76-88.
4. Trogarzo (ibalizumab-uiyk) ulotka dołączona do opakowania. Montreal, Quebec: Theratechnologies Inc; marzec 2018.
5. Pifeltro (doravirine) ulotka dołączona do opakowania. Whitehouse Station, NJ: Merck & Co, Inc; marzec 2019.
6. Rukobia (fostemsavir) ulotka dołączona do opakowania. Research Triangle Park, NC: GlaxoSmithKline; lipiec 2020.
7. Pan F, Chernew ME, Fendrick AM. Impact of fixed-dose combination drugs on adherence to prescription medications. J Gen Intern Med. 2008;23(5):611-614.
8. Verma AA, Khuu W, Tadrous M,et al. Fixed-dose combination antihypertensive medications, adherence, and clinical outcomes: a population-based retrospective cohort study. PLoS Med. 2018;15(6):e1002584.
9. National Institutes of Health. HIVinfo. FDA-approved HIV medicines. hivinfo.nih.gov/understanding-hiv/fact-sheets/fda-approved-hiv-medicines. Dostęp 22 września 2020 r.
10. Prezista (darunawir) ulotka dołączona do opakowania. Titusville, NJ: Janssen Therapeutics; maj 2019 r.
11. Truvada (emtricitabine/tenofovir disoproxil fumarate) ulotka dołączona do opakowania. Foster City, CA: Gilead Sciences, Inc; czerwiec 2004/2020.
12. Delstrigo (doravirine/lamivudine/tenofovir disproxil fumerate) ulotka dołączona do opakowania. White House Starion, NJ: Merck & Co, Inc; sierpień 2018 r.
13. Descovy (emtricitabine/tenofovir alafenamide) ulotka dołączona do opakowania. Foster City, CA: Gilead Sciences, Inc; grudzień 2019 r.
14. Tivicay (dolutegravir) ulotka dołączona do opakowania. Research Triangle Park, NC. GlaxoSmithKline; czerwiec 2020 r.
15. Iacob SA, Iacob DG. Ibalizumab targeting CD4 receptors, an emerging molecule in HIV therapy. Front Microbiol. 2017;8:2323.
16. Emu B, Fessel J, Schrader S, et al. Phase 3 study of ibalizumab for multidrug-resistant HIV-1. N Engl J Med. 2018;379:645-654.
17. Li Z, Zhou N, Sun Y, et al. Activity of the HIV-1 attachment inhibitor BMS-626529, the active component of the prodrug BMS-663068, against CD4-independent viruses and HIV-1 envelopes resistant to other entry inhibitors. Antimicrob Agents Chemother. 2013:57(9):4172-4180.
18. Kozal M, Aberg J, Pialoux G. Fostemsavir in adults with multidrug-resistant HIV-1 infection. N Engl J Med. 2020;382(13):1232-1243.
19. Cahn P, Fink V, Patterson P. Fostemsavir: a new CD4 attachment inhibitor. Curr Opin HIV AIDS. 2018;13(4):341-345.
20. Biktarvy (bictecgravir/emtricitabine/tenofovir alafenamide) ulotka dołączona do opakowania. Foster City, CA: Gilead Sceinces, Inc; luty 2018.
21. Gallant J, Lazzarin A, Mills M, et al. Bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir, abacavir, and lamivudine for initial treatment of HIV-1 infection (GS-US-380-1489): a double-blind, multicentre, phase 3, randomised controlled non-inferiority trial. Lancet. 2017;390(10107):2063-2072.
22. Sax PE, Pozniak A, Montes M, et al. Coformulated bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir with emtricitabine and tenofovir alafenamide, for initial treatment of HIV-1 infection (GS-US-380-1490): a randomised, double-blind, multicentre, phase 3, non-inferiority trial. Lancet. 2017;390(10107):2073-2082.
23. Malina JM, Ward D, Brar I, et al. Switching to fixed-dose bictegravir, emtricitabine, and tenofovir alafenamide from dolutegravir plus abacavir andlamivudine in virologically suppressed adults with HIV-1: 48 week results of a randomised, double-blind, multicentre, active-controlled, phase 3, non-inferiority trial. Lancet HIV. 2018;5(7):E357-E365.
24. Daar ES, De Jesus E, Ruane P, et al. Skuteczność i bezpieczeństwo przejścia na stałe dawki bictegraviru, emtricitabiny i tenofoviru alafenamidu z boostowanych schematów opartych na inhibitorach proteazy u wirusologicznie supresyjnych dorosłych z HIV-1: 48-tygodniowe wyniki randomizowanego, otwartego, wieloośrodkowego, wieloośrodkowego, fazy 3, badania non-inferiority. Lancet HIV. 2018;5(7):e347-e356.
25. Dovato (dolutegravir/lamivudine) ulotka dołączona do opakowania. Research Triangle Park, NC: GlaxoSmithKline. March 2020.
26. Scott LJ. Dolutegravir/lamivudine single-tablet regimen: a review in HIV-1 infection. Drugs. 2020;80(1):61-72.
27. Cahn P, Madero JS, Arribas JR, et al. GEMINI Study Team. Dolutegravir plus lamiwudyna versus dolutegravir plus tenofovir disoproxil fumarate and emtricitabine in antiretroviral-naive adults with HIV-1 infection (GEMINI-1 and GEMINI-2): week 48 results from two multicentre, double-blind, randomised, non-inferiority, phase 3 trials. Lancet. 2019;393(10167):143-155.
28. Mayer KH, Molina JM, Thompson MA, et al. Emtricitabine and tenofovir alafenamide vs. emtricitabine and tenofovir disoproxil fumarate for HIV pre-exposure prophylaxis (DISCOVER): primary results from a randomised, double-blind multicentre, active-controlled, phase 3 non-inferiority trial. Lancet. 2020;396(10246):239-254.
29. Hill A, Hughes SL, Gotham D, Pozniak AL. Tenofovir alafenamide versus tenofovir disoproxil fumarate: is there a true difference in efficacy and safety? J Virus Erad. 2018;4(2):72-79.