Fisiologia VIVO
Estrutura da Insulina
>
Insulina é composta por duas cadeias de peptídeos referidas como cadeia A e cadeia B. As cadeias A e B são ligadas entre si por duas cadeias de dissulfeto, e um dissulfeto adicional é formado dentro da cadeia A. Na maioria das espécies, a cadeia A consiste de 21 aminoácidos e a cadeia B de 30 aminoácidos.
Embora a seqüência de aminoácidos da insulina varie entre as espécies, certos segmentos da molécula são altamente conservados, incluindo as posições das três ligações de dissulfeto, ambas as extremidades da cadeia A e os resíduos terminais C da cadeia B. Estas semelhanças na sequência de aminoácidos da insulina levam a uma conformação tridimensional da insulina que é muito semelhante entre as espécies, e a insulina de um animal é muito provavelmente biologicamente ativa em outras espécies. De fato, a insulina de porco tem sido amplamente utilizada para tratar pacientes humanos.
As moléculas de insulina têm tendência a formar dímeros em solução devido à ligação de hidrogênio entre os termini C das cadeias B. Além disso, na presença de íons de zinco, os dímeros de insulina se associam em hexameros.
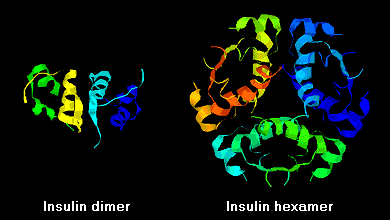
Estas interações têm importantes ramificações clínicas. Monômeros e dímeros se difundem facilmente no sangue, enquanto que os hexameros se difundem mal. Assim, a absorção de preparações de insulina contendo uma alta proporção de hexaméros é retardada e um pouco lenta. Este fenómeno, entre outros, estimulou o desenvolvimento de uma série de análogos recombinantes de insulina. A primeira destas moléculas a ser comercializada – chamada insulina lispro – é concebida de tal forma que os resíduos de lisina e prolina na extremidade terminal C da cadeia B são invertidos; esta modificação não altera a ligação dos receptores, mas minimiza a tendência de formar dímeros e hexameres.