Objectivos de Aprendizagem
- Identificar alcanos, alcenos, alcinos e compostos aromáticos.
- Lista algumas propriedades dos hidrocarbonetos.
Os compostos orgânicos mais simples são os compostos compostos compostos de apenas dois elementos: carbono e hidrogênio. Estes compostos são chamados de hidrocarbonetos. Os próprios hidrocarbonetos são separados em dois tipos: hidrocarbonetos alifáticos e hidrocarbonetos aromáticos. Os hidrocarbonetos alifáticos são hidrocarbonetos baseados em cadeias de átomos de C. Existem três tipos de hidrocarbonetos alifáticos. Os alcanos são hidrocarbonetos alifáticos com ligações covalentes únicas. Os alcenos são hidrocarbonetos alifáticos que contêm pelo menos uma ligação dupla C-C, e os alcinos são hidrocarbonetos alifáticos que contêm uma ligação tripla C-C. Ocasionalmente, encontramos um hidrocarboneto alifático com um anel de átomos de C; estes hidrocarbonetos são chamados cicloalcanos (ou cicloalcenos ou cicloalcinos).
Hidrocarbonetos aromáticos, como o benzeno, são sistemas de anel plano que contêm orbitais p continuamente sobrepostos.Os electrões no anel do benzeno têm propriedades energéticas especiais que dão ao benzeno propriedades físicas e químicas que são marcadamente diferentes dos alcanos. Originalmente, o termo aromático era usado para descrever esta classe de compostos porque eles eram particularmente perfumados. No entanto, na química moderna o termo aromático denota a presença de um anel muito estável que confere propriedades diferentes e únicas a uma molécula.
Os alcanos mais simples têm os seus átomos C ligados numa cadeia recta; estes são chamados alcanos normais. Eles são nomeados de acordo com o número de átomos de C na cadeia. O menor alcano é o metano:
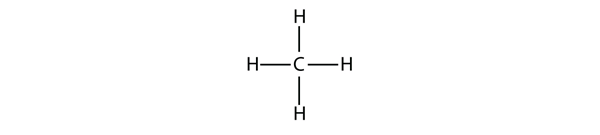
Figure 16.1 Representação Tridimensional do Metano

Para fazer quatro ligações covalentes, o átomo C liga-se a quatro átomos de H, fazendo a fórmula molecular para o metano CH4. O diagrama bidimensional para o metano é enganador, contudo, as quatro ligações covalentes que o átomo C faz são orientadas tridimensionalmente para os cantos de um tetraedro. Uma melhor representação da molécula de metano é mostrada na Figura 16.1 “Representação Tridimensional do Metano”
O próximo maior alcano tem dois átomos de C que estão covalentemente ligados um ao outro. Para que cada átomo de C faça quatro ligações covalentes, cada átomo de C deve ser ligado a três átomos de H. A molécula resultante, cuja fórmula é C2H6, é etano:
>434343>
Propano tem uma espinha dorsal de três átomos de C rodeada por átomos de H. Você deve ser capaz de verificar que a fórmula molecular do propano é C3H8:
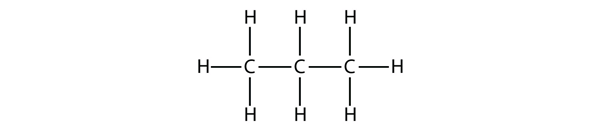
Os diagramas que vimos até agora representando os alcanos são estruturas Lewis bastante semelhantes. Contudo, à medida que as moléculas se tornam maiores, as estruturas de Lewis tornam-se cada vez mais complexas. Uma maneira de contornar isto é usar uma estrutura condensada, que lista a fórmula de cada átomo C na espinha dorsal da molécula. Por exemplo, a estrutura condensada do etano é CH3CH3, enquanto que a do propano é CH3CH2CH3. A tabela 16.1 “Os 10 primeiros alcanos” dá as fórmulas moleculares, as fórmulas estruturais condensadas e os nomes dos 10 primeiros alcanos.
Tabela 16.1 Os 10 primeiros alcanos
| Fórmula molecular | Fórmula estrutural condensada | Nome |
|---|---|---|
| CH4 | CH4 | metano |
| C2H6 | CH3CH3CH3 | etano |
| C3H8 | CH3CH2CH3 | propano |
| C4H10 | CH3CH2CH2CH3 | butano |
| C5H12 | CH3CH2CH2CH2CH3 | pentano |
| C6H14 | CH3(CH2)4CH3 | hexano |
| C7H16 | CH3(CH2)5CH3 | heptano |
| C8H18 | CH3(CH2)6CH3 | octano |
| C9H20 | CH3(CH2)7CH3 | nonano |
| C10H22 | CH3(CH2)8CH3 | decano |
Porque os alcanos têm o número máximo de átomos H possível de acordo com as regras das ligações covalentes, Os alcanos também são referidos como hidrocarbonetos saturados.
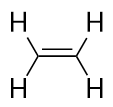
Alkenes têm uma ligação dupla C-C. Por terem menos do que o número máximo de átomos H possível, são chamados de hidrocarbonetos insaturados. O menor alceno-eteno tem dois átomos de C e é também conhecido pelo seu nome comum, etileno:
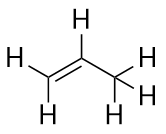
O próximo maior alceno-propeno tem três átomos de C com uma ligação dupla de C-C entre dois dos átomos de C. Também é conhecido como propileno:
O que você observa sobre os nomes de alcanos e alcenos? Os nomes dos alcenos são os mesmos dos alcanos correspondentes, exceto que o sufixo (final) é -eno, em vez de -ano. Usar um caule conhecido como a cadeia mãe para indicar o número de átomos C numa molécula e um final para representar o tipo de composto orgânico é comum na química orgânica, como veremos.
Com a introdução do próximo alceno, buteno, começamos a ver um grande problema com moléculas orgânicas: escolhas. Com quatro átomos de C, a ligação dupla C-C pode ir entre o primeiro e o segundo átomos de C ou entre o segundo e o terceiro átomos de C:
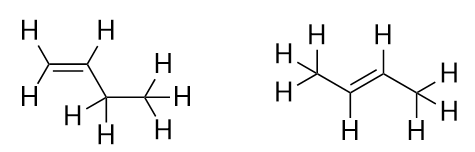
(Uma ligação dupla entre o terceiro e o quarto átomos de C é o mesmo que tê-la entre o primeiro e o segundo átomos de C, apenas virada). As regras de nomeação em química orgânica exigem que estas duas substâncias tenham nomes diferentes. A primeira molécula é denominada but-1-eno, enquanto a segunda molécula é denominada but-2-eno. O número entre o nome da cadeia mãe e o sufixo é conhecido como locant, e indica em que carbono se origina a dupla ligação. O menor número possível é usado para numerar uma característica em uma molécula; portanto, chamar a segunda molécula de but-3-eno seria incorreto. Os números são partes comuns de nomes químicos orgânicos porque indicam qual átomo C de uma cadeia contém uma característica distintiva. Quando a dupla ligação (ou outro grupo funcional) está localizada no primeiro carbono, é prática comum de alguns autores deixarem de fora o locante. Por exemplo, se o buteno foi escrito sem um locante, você deve assumir que se refere ao buteno-1, não ao buteno-2.
Os compostos buteno-1 e buteno-2 têm propriedades físicas e químicas diferentes, embora tenham a mesma fórmula molecular – C4H8. Moléculas diferentes com a mesma fórmula molecular são chamadas de isômeros. Os isómeros são comuns na química orgânica e contribuem para a sua complexidade.
Exemplo 1
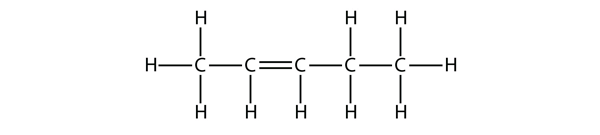
Baseado nos nomes das moléculas de buteno, proponha um nome para esta molécula.
Solução
Com cinco átomos de C, vamos usar o nome do pai-caneta, e com uma ligação dupla de C-C, este é um alceno, por isso esta molécula é um penteno. Na numeração dos átomos de C, usamos o número 2 porque é o rótulo mais baixo possível. Então esta molécula é chamada pent-2-eno.
Test Yourself
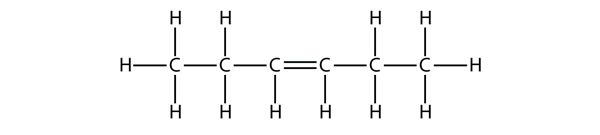
Baseado nos nomes para as moléculas de buteno, proponha um nome para esta molécula.
Resposta
hex-3-ene
Alkynes, com uma ligação tripla C-C, são nomeados de forma semelhante aos alcenos, excepto que os seus nomes terminam em -yne. O menor alquino é o etino, também conhecido como acetileno:
![]()
Propyne tem esta estrutura:
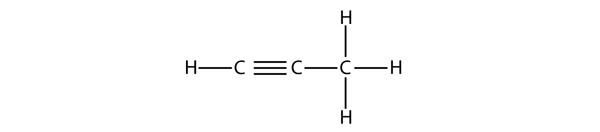
Com butino, precisamos começar a numerar a posição da tripla ligação, assim como fizemos com alcenos:
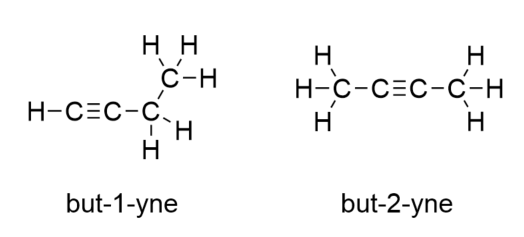
Benzeno é um composto aromático composto de seis átomos de C num anel, com ligações alternadas de C-C simples e duplo:
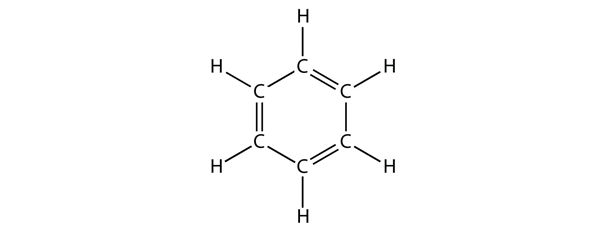
As ligações alternadas de C-C simples e duplo dão ao anel de benzeno uma estabilidade especial, e não reage como um alceno, como seria de esperar.
Como os hidrocarbonetos são fundamentais para a química orgânica, as suas propriedades e reacções químicas são bastante mundanas. A maioria dos hidrocarbonetos são não-polares devido às eletronegatividades próximas dos átomos C e H. Como tal, eles dissolvem-se apenas moderadamente em H2O e outros solventes polares. Pequenos hidrocarbonetos, como o metano e o etano, são gases à temperatura ambiente, enquanto os hidrocarbonetos maiores, como o hexano e o octano, são líquidos. Mesmo hidrocarbonetos maiores, como o hentriacontano (C31H64), são sólidos à temperatura ambiente e têm uma consistência suave e cerosa.
Hidrocarbonetos são bastante pouco reativos, mas eles participam de algumas reações químicas clássicas. Uma reacção comum é a substituição por um átomo de halogéneo, combinando um hidrocarboneto com um halogéneo elementar. A luz é por vezes utilizada para promover a reacção, como esta entre metano e cloro:
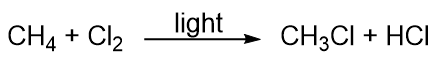
Halogéneos também podem reagir com alcenos e alcinos, mas a reacção é diferente. Nestes casos, as moléculas halógenas reagem com a dupla ou tripla ligação C-C e fixam-se em cada átomo C envolvido nas múltiplas ligações. Esta reação é chamada reação de adição. Um exemplo é
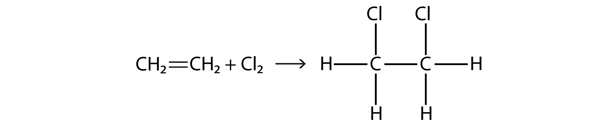
As condições de reação são geralmente leves; em muitos casos, o halógeno reage espontaneamente com um alceno ou um alqueno.
Hidrogênio também pode ser adicionado através de uma ligação múltipla; esta reação é chamada de reação de hidrogenação. Neste caso, no entanto, as condições de reação podem não ser leves; pressões elevadas de gás H2 podem ser necessárias. Um catalisador de platina ou paládio é normalmente empregado para que a reação prossiga a um ritmo razoável:
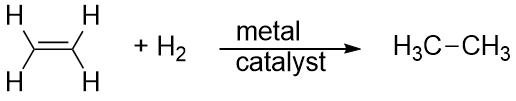
De longe a reação mais comum dos hidrocarbonetos é a combustão, que é a combinação de um hidrocarboneto com O2 para fazer CO2 e H2O. A combustão de hidrocarbonetos é acompanhada por uma liberação de energia e é uma fonte primária de produção de energia em nossa sociedade (Figura 16.2 “Combustão”). A reação de combustão da gasolina, por exemplo, que pode ser representada pelo C8H18, é a seguinte:
2 C8H18 + 25 O2 → 16 CO2 + 18 H2O + ~5060 kJ
Figure 16.2 Combustão
