ABSTRACT: Medicamentele antiretrovirale (ARV) disponibile pentru tratamentul HIV s-au extins din 2018. Au fost aprobate noi tipuri de ARV cu noi mecanisme de acțiune, inclusiv ibalizumab-uiyk și fostemsavir. De asemenea, au fost aprobate comprimate combinate de medicamente disponibile anterior, cum ar fi bictegravir/emtricitabină/tenofovir alafenamidă și dolutegravir/lamivudină. În cele din urmă, a existat o extindere a indicațiilor aprobate pentru ARV-urile disponibile anterior în sine, cum ar fi emtricitabina/tenofovir alafenamida pentru utilizare în profilaxia pre-expunere.
US Pharm. 2020:45(10):17-25.
Principalii agenți antiretrovirali (ARV) pentru tratamentul HIV au constat în mare parte din aceeași mână de clase de medicamente de ani de zile. Tratamentul HIV a fost încercat pentru prima dată cu inhibitori nucleozidici ai transcriptazei inverse (NRTI), prima clasă de ARV aprobată de FDA. Treptat, au fost descoperite din ce în ce mai multe clase și au fost puse la dispoziție pentru tratament în diverse regimuri, adesea complexe (TABELUL 1).1-3 După aprobarea raltegravirului în 2007, noile aprobări de medicamente pentru HIV au fost în mare parte pentru medicamente disponibile reprofilate și pentru noi combinații de medicamente. Acest lucru s-a schimbat în 2018, odată cu aprobarea ibalizumab-uiyk, primul ARV nou în peste un deceniu.4 Ibalizumab-uiyk a fost urmat rapid de un nou inhibitor nonnucleozidic al transcriptazei inverse (NNRTI), doravirina, mai târziu în acel an și de un nou inhibitor de atașare, fostemsavir, în 2020 (TABELUL 2).5-7
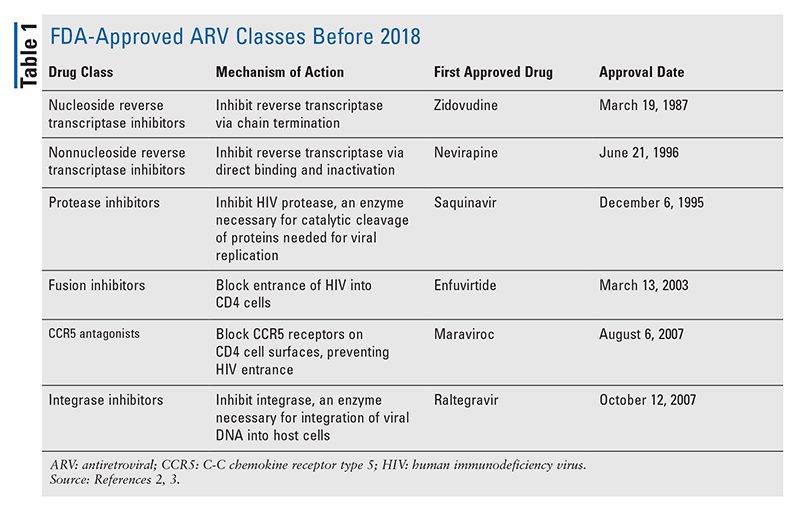
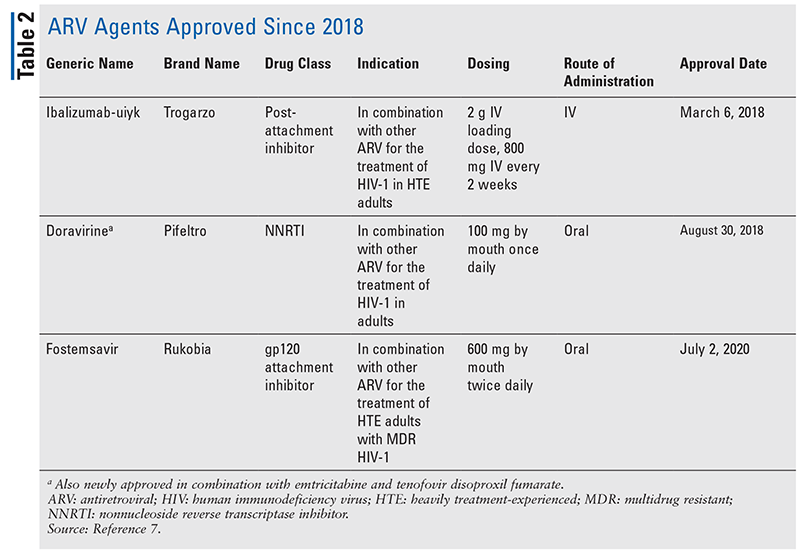
În timp ce medicamentele noi sunt adesea cele mai interesante aprobări de medicamente noi, ARV-urile s-au îmbunătățit în alte moduri. Având în vedere povara enormă de pilule a multor regimuri HIV, combinațiile ARV recent aprobate (TABELUL 3) pot face viața pacienților mult mai ușoară. Utilizarea unor astfel de agenți și limitarea încărcăturii necesare de pilule au demonstrat o mai bună aderență și rezultate generale.8,9 Au existat, de asemenea, extinderi ale indicațiilor aprobate pentru ARV-urile disponibile anterior (TABELUL 4), oferind noi opțiuni pentru anumite populații de pacienți și indicații.10-14
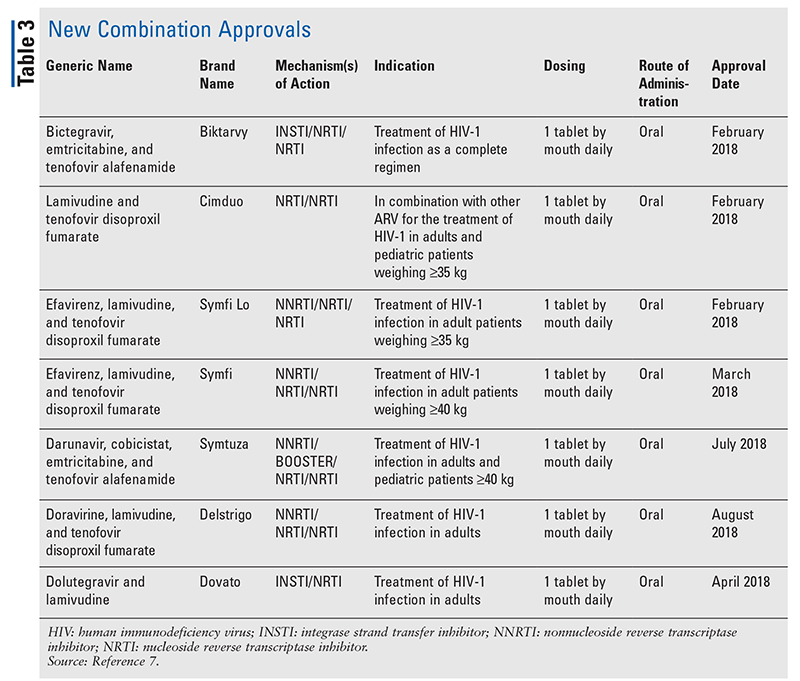
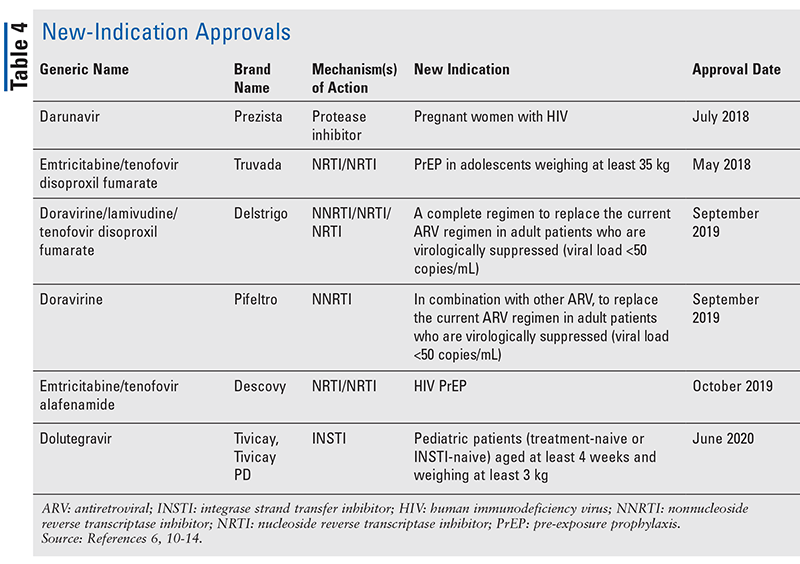
Deși există multe aprobări noi din 2018, acest articol prezintă profilul a patru dintre medicamentele nou aprobate și o nouă indicație. Aceste aprobări au fost selectate pentru a demonstra un eșantion din marea varietate de agenți noi care devin disponibili, precum și pentru a sublinia unele opțiuni noi care oferă o oportunitate unică în tratamentul HIV.
Ibalizumab-Uiyk (Trogarzo)
Ibalizumab-uiyk este un anticorp monoclonal recombinant injectabil care se leagă de proteinele de suprafață ale celulelor CD4, ceea ce duce la modificări conformaționale care împiedică etapele post-atașare necesare pentru fuziunea HIV-1 și intrarea în celulă. Este singurul medicament monoclonal utilizat în tratamentul HIV. Datorită specificității sale unice de legare, ibalizumab-uiyk blochează intrarea virală fără a provoca imunosupresie, o preocupare în cazul multor medicamente monoclonale.4,15 Este indicat în asociere cu alte ARV pentru tratamentul adulților cu experiență de tratament intensivă (HTE) cu HIV-1 multidrog rezistent (MDR) care nu reușesc să își administreze regimul actual de tratament ARV.4
Aprobarea ibalizumab-uiyk s-a bazat pe un studiu efectuat pe 40 de pacienți HIV HTE cu încărcătură virală mai mare de 1.000 copii/mL și rezistență documentată la cel puțin un INRT, INNRT și un inhibitor de protează. De asemenea, pacienții trebuiau să fi avut cel puțin 6 luni de tratament și să fi eșuat recent la tratament. Studiul a inclus trei perioade, începând cu o perioadă de 6 zile în care a fost stabilită și confirmată încărcătura virală de bază (perioada de control). În ziua 7, pacienții au primit o doză de încărcare de 2.000 mg de ibalizumab-uiyk în plus față de regimul standard de tratament antiretroviral (perioada de monoterapie funcțională). În ziua 14, sarcina virală a fost reevaluată, iar regimurile au fost monitorizate și ajustate pentru a asigura o activitate adecvată împotriva infecției lor cu HIV. Ibalizumab-uiyk 800 mg a fost administrat intravenos la fiecare 2 săptămâni până la încheierea studiului (perioada de întreținere). Criteriul principal de evaluare a evaluat diferența în ceea ce privește proporția de scădere a încărcăturii virale de la perioada de control la perioada de monoterapie funcțională, comparând în mod specific procentul de pacienți cu o scădere ³0,5 log10 a încărcăturii virale globale. În timpul perioadei de control, s-a constatat că 3% dintre pacienți au înregistrat o astfel de scădere, în timp ce în perioada de monoterapie funcțională, 83% dintre pacienți au atins scăderea indicată a încărcăturii virale. La sfârșitul celor 25 de săptămâni, 43% dintre pacienți au obținut o încărcătură virală de <50 de copii/mL.16
Pe baza acestui studiu, doza aprobată de ibalizumab-uiyk este o doză de încărcare IV unică de 2.000 mg, urmată de o doză de întreținere IV de 800 mg la fiecare 2 săptămâni.4,16 Este necesară o monitorizare atentă timp de 1 oră după administrarea primei perfuzii pentru reacții legate de perfuzie, monitorizarea perfuziei ulterioare fiind redusă la 15 minute după tolerarea dozei inițiale.4 Ibalizumab-uiyk pare a fi altfel bine tolerat; cele mai multe efecte adverse asociate cu ibalizumab-uiyk au fost greață, amețeli și diaree.4,16
Fostemsavir (Rukobia)
Fostemsavirul este un nou ARV indicat pentru terapia de asociere la adulții HTE cu HIV-1 MDR cunoscut, în special pentru pacienții la care nu reușesc tratamentul antiretroviral actual din cauza rezistenței potențiale, a intoleranței sau din considerente de siguranță.4 Este primul inhibitor de atașament aprobat de FDA. După activarea enzimatică în molecula activă temsavir, acesta se leagă de gp120, o glicoproteină a învelișului viral necesară pentru atașarea virală la celulele CD4. Acest lucru împiedică intrarea virusului în celulele CD4, oprind efectiv replicarea virală. Datorită acestui mecanism nou, este puțin probabil ca fostemsavirul să inducă rezistență la el însuși prin presiunea selectivă asociată cu majoritatea celorlalte ARV.6,17
Fostemsavir a fost evaluat atât din punct de vedere al siguranței, cât și al eficacității într-un studiu clinic randomizat, dublu-orb, controlat cu placebo (BRIGHTE) care a inclus 371 de pacienți cu HIV-1 HTE.16,17 Pacienții din cohorta principală au fost tratați atât cu regimul lor ARV de bază, împreună cu fostemsavir 600 mg de două ori pe zi, cât și cu placebo, pentru un total de 8 zile. La evaluarea din ziua 8, pacienții cu fostemsavir au demonstrat niveluri serice semnificativ mai scăzute ale ARN HIV viral. După această perioadă inițială de tratament, toți pacienții au fost trecuți la fostemsavir 600 mg de două ori pe zi. La 24 de săptămâni, 53% dintre participanții la studiu au atins niveluri efective nedetectabile de supresie virală, supresia îmbunătățindu-se la 60% în săptămâna 96.17,18
Cel mai frecvent raportat efect advers al fostemsavirului a fost greața. Reacții mai severe, inclusiv creșteri ale enzimelor hepatice, au fost raportate la pacienții cu coinfecție cu hepatita B sau C.17,18 Alte studii au raportat o incidență minoră de cefalee, erupții cutanate și diaree. Metabolitul activ temsavir este metabolizat de CYP3A4, astfel încât trebuie evitați inductorii puternici, cum ar fi carbamazepina, rifampicina și sunătoarea, pentru a preveni scăderea concentrației serice a temsavirului. 17-19
Bictegravir/Emtricitabină/TenofovirAlafenamidă (Biktarvy)
Bictegravir/emtricitabină/tenofovir alafenamidă (BIC/FTC/TAF) este un comprimat combinat cu doză fixă, cu administrare o dată pe zi, care conține un nou inhibitor de integrază și doi inhibitori nucleozidici/nucleotidici ai transcriptazei inverse. Componentele individuale din Biktarvy sunt bictegravir 50 mg (un inhibitor al transferului de catenă al integrasei ), emtricitabină 200 mg (un INRT) și tenofovir alafenamidă 25 mg (un INRT). BIC/FTC/TAF este indicat ca regim complet la adulții infectați cu HIV-1 fără antecedente de tratament antiretroviral sau pentru a înlocui regimul antiretroviral actual al pacienților care sunt suprimați virologic (încărcătură virală de 50 de copii pe ml) cu un regim antiretroviral stabil de cel puțin 3 luni și fără antecedente de eșec al tratamentului sau rezistență la componentele sale individuale. Cel mai important, este un regim complet, cu o singură pastilă, care nu necesită alte ARV.20
BIC/FTC/TAF a fost aprobat în 2018 după patru studii clinice. Două dintre studiile clinice au testat eficacitatea și siguranța BIC/FTC/TAF la pacienții fără antecedente de tratament antiretroviral: Studiul 1489 (randomizat, BIC/FTC/TAF vs. abacavir/ dolutegravir/lamivudină, și Studiul 1490 (randomizat, BIC/FTC/TAF vs. dolutegravir + emtricitabină/tenofovir alafenamidă ).21,22 În studiul 1489, criteriul principal de evaluare a încărcăturii virale <50 copii/mL a fost atins la 92% din grupul BIC/FTC/TAF și la 93% din grupul ABC/DTG/3TC (diferență de tratament de -0,6%; interval de încredere de 95% , -4,8% până la 3,6%). În cadrul studiului 1490, criteriul principal de evaluare a încărcăturii virale <50 copii/mL a fost atins la 89% din grupul BIC/FTC/TAF și la 93% din grupul DTG + FTC/TAF (diferență de tratament de -3,5%; IC 95%, -7,9% la 1,0%).21,22
Celelalte două studii au testat eficacitatea și siguranța BIC/FTC/TAF la pacienții cu supresie virologică care urmau să fie trecuți de la regimurile ART actuale la BIC/FTC/TAF: Studiul 1844 (randomizat, trecerea de la dolutegravir plus abacavir/lamivudină sau ABC/DTG/3TC la BIC/FTC/TAF) și studiul 1878 (deschis, trecerea de la atazanavir sau darunavir amplificat plus abacavir/emtricitabină sau emtricitabină/tenofovir disoproxil fumarat la BIC/FTC/TAF).23,24 În studiul 1844, punctul final primar al pacienților care și-au pierdut statutul de supresie virologică (încărcătură virală ³50 de copii pe ml) a fost observat la 1% din grupul BIC/FTC/TAF și la <1% din grupul cu regimul inițial (diferență de tratament de 0,7%, IC 95%, -1,0% la 2,8%). În studiul 1878, punctul final primar al pacienților care și-au pierdut statutul de supresie virologică a fost observat la 2% din grupul BIC/FTC/TAF și la 2% din grupul cu regimul inițial (diferență de tratament de 0,0%; IC 95%, -2,5% până la 2,5%).23,24
BIC/FTC/TAF se administrează o dată pe zi, pe cale orală, cu sau fără alimente. Cele mai frecvent raportate reacții adverse observate la pacienți au fost diaree, greață și cefalee.20-24
Dolutegravir/Lamivudină (Dovato)
Combinația dolutegravir/lamivudină (DTG/3TC), un INSTI și NRTI, a fost aprobată în 2019. Acesta este primul regim complet cu două medicamente, în doză fixă, pentru tratamentul infecției cu HIV-1 la pacienții adulți naivi la tratament. Acest lucru contrastează cu opțiunile de regimuri standard de tratament cu trei medicamente solicitate în mod tradițional. Acest lucru poate oferi o oportunitate în cazul pacienților care nu pot tolera niciunul dintre cele mai frecvente regimuri cu trei medicamente din cauza efectelor adverse sau a interacțiunilor medicamentoase inevitabile.25,26
Eficacitatea și siguranța combinației dolutegravir/lamivudină au fost demonstrate în două studii identice, GEMINI-1 și GEMINI-2.27 Aceste studii au inclus un total de 1 433 de adulți infectați cu HIV-1, naivi de tratament, care au fost randomizați pentru a primi un regim cu două medicamente, dolutegravir 50 mg plus lamivudină 150 mg, sau un regim cu trei medicamente, dolutegravir plus emtricitabină plus fumarat de tenofovir disoproxil. Criteriul principal de evaluare al atingerii unei încărcături virale <50 de copii/mL a arătat că DTG/3TC a fost noninferior – 91% dintre cei 716 pacienți cu două medicamente și 93% dintre cei 717 pacienți cu trei medicamente (diferență de tratament de -1,7%; IC 95%, -4,4% la 1,1%) – atunci când rezultatele celor două studii au fost reunite. Studiile reunite au arătat, de asemenea, că, din punct de vedere numeric, mai puțini pacienți au avut evenimente adverse legate de medicamente în cadrul regimului cu două medicamente, spre deosebire de regimul cu trei medicamente (126 din 716 și, respectiv, 169 din 717 , respectiv). Datorită eficacității noninferioare și a unui profil de tolerabilitate similar, Departamentul de Sănătate și Servicii Umane a putut include combinația DTG/3TC în doză fixă în ghidurile privind HIV/SIDA ca regim inițial recomandat pentru majoritatea persoanelor cu HIV.27
Combinația dolutegravir/lamivudină se administrează o dată pe zi, pe cale orală, cu sau fără alimente. Cele mai frecvente reacții adverse observate la pacienți sunt cefaleea, greața, diareea, oboseala și insomnia. În ciuda faptului că este un comprimat combinat cu două medicamente, nu este necesar să fie administrat împreună cu alte medicamente ARV, deoarece este un regim de terapie completă.25-27
Emtricitabină/tenofovir alafenamidă pentru profilaxia pre-expunere (PrEP)
Din 2012, singura opțiune aprobată de FDA pentru PrEP a fost FTC/ TDF.11 Acest lucru s-a schimbat în 2019, odată cu aprobarea combinației emtricitabină/tenofovir alafenamidă (FTC/TAF),13 un medicament combinat similar din punct de vedere structural. Acesta este acum indicat pentru utilizarea în PrEP la pacienții neinfectați care prezintă un risc ridicat de transmitere a HIV prin relații sexuale. Acest lucru exclude pacienții cu risc prin relații sexuale vaginale receptive, deoarece această populație nu a fost încă evaluată.
Aprobarea PrEP se bazează pe recentul studiu DISCOVER, un studiu randomizat, dublu-orb, care a comparat FTC/TAF cu FTC/TDF, care reprezintă tratamentul standard, în ceea ce privește reducerea riscului de contractare a infecției cu HIV-1 la bărbații și femeile transsexuale care au relații sexuale cu bărbați și prezintă risc de infectare cu HIV-1.7 Studiul a fost efectuat sub forma unui studiu randomizat, dublu-orb, cu grupuri paralele, cu o urmărire minimă de 48 de săptămâni, cu cel puțin 50% dintre participanți având 96 de săptămâni de urmărire după randomizare. Au fost înrolați 5.399 de participanți care au fost randomizați 1:1 în oricare dintre cele două grupuri. Obiectivul principal al studiului a fost de a evalua incidența infecției cu HIV-1 la 100 de persoane/an. Dintre cei 2.694 de participanți din grupul FTC/TAF, incidența HIV-1 a fost observată la 7 pacienți (0,16/100 persoane/an). În rândul celor 2.693 de participanți din cadrul brațului FTC/TDF, incidența HIV-1 a fost observată la 15 pacienți (0,34/100 persoane-an). Aceste incidențe demonstrează că FTC/TAF a fost noninferior față de FTC/TDF la participanții la studiu care prezentau risc de a contracta HIV și, în cele din urmă, a permis FDA să adauge PrEP la indicațiile pentru FTC/TAF.13
Este probabil ca locul FTC/TAF în terapia HIV să fie încă neclar. Deși și-a găsit utilizarea în alte domenii ale tratamentului HIV, beneficiul său față de alternativă în acest context nu a fost încă determinat în mod concludent. Deși similar, TAF ar putea oferi o incidență mai mică a modificărilor densității osoase și a disfuncției renale, efecte adverse asociate cu TDF. Cu toate acestea, această diferență nu este bine stabilită, unele date sugerând că, în regimurile care nu includ un rapel farmacocinetic, cum ar fi cobicistat sau ritonavir, acest beneficiu poate să nu fie semnificativ din punct de vedere clinic. 27-29
Concluzie
Din cauza complexității HIV și a potențialului său de rezistență, terapia ARV poate deveni rapid împovărătoare pentru pacienți. Între 2018 și până în prezent, comunitatea medicală a asistat la o extindere largă a terapiilor ARV aprobate de FDA pentru tratamentul HIV. Aceste terapii includ noi comprimate combinate cu doză fixă; noi medicamente care acționează prin mecanisme diferite față de cele existente anterior pe piață și chiar noi indicații pentru medicamente existente anterior. Aceste noi medicamente au avut deja un impact asupra ghidurilor actuale de tratament și pot ajuta pacienții să trăiască o viață mai lungă și mai sănătoasă.
Contenutul acestui articol are doar scop informativ. Conținutul nu este menit să înlocuiască consilierea profesională. Încrederea în orice informație furnizată în acest articol se face exclusiv pe propriul risc.
1. Vella S, Schwartländer B, Sow SP, et al. Istoria terapiei antiretrovirale și a implementării acesteia în zonele cu resurse limitate din lume. SIDA. 2012;26(10):1231-1241.
2. Arts EJ, Hazuda DJ. Terapia cu medicamente antiretrovirale HIV-1. Cold Spring Harb Perspect Med. 2012;2(4):a007161.
3. Chaudhuri S, Symons JA, Deval J. Innovation and trends in the development and approval of antiviral medicines: 1987-2017 și ulterior. Antiviral Res. 2018;155:76-88.
4. Trogarzo (ibalizumab-uiyk) prospect. Montreal, Quebec: Theratechnologies Inc; martie 2018.
5. Pifeltro (doravirină) prospect de prezentare. Whitehouse Station, NJ: Merck & Co, Inc; martie 2019.
6. Rukobia (fostemsavir) prospectul ambalajului. Research Triangle Park, NC: GlaxoSmithKline; iulie 2020.
7. Pan F, Chernew ME, Fendrick AM. Impactul medicamentelor combinate cu doză fixă asupra aderenței la medicamentele prescrise. J Gen Intern Med. 2008;23(5):611-614.
8. Verma AA, Khuu W, Tadrous M,et al. Fixed-dose combination antihypertensive medications, adherence, and clinical outcomes: a population-based retrospective cohort study. PLoS Med. 2018;15(6):e1002584.
9. Institutele Naționale de Sănătate. HIVinfo. Medicamente pentru HIV aprobate de FDA. hivinfo.nih.gov/understanding-hiv/fact-sheets/fda-approved-hiv-medicines. Accesat la 22 septembrie 2020.
10. Prezista (darunavir) prospect. Titusville, NJ: Janssen Therapeutics; mai 2019.
11. Truvada (emtricitabină/tenofovir disoproxil fumarat) prospect. Foster City, CA: Gilead Sciences, Inc; iunie 2004/2020.
12. Delstrigo (doravirină/lamivudină/tenofovir disproxil fumerat) prospect. White House Starion, NJ: Merck & Co, Inc; august 2018.
13. Prospectul Descovy (emtricitabină/tenofovir alafenamidă). Foster City, CA: Gilead Sciences, Inc; decembrie 2019.
14. Tivicay (dolutegravir) prospectul ambalajului. Research Triangle Park, NC. GlaxoSmithKline; iunie 2020.
15. Iacob SA, Iacob DG. Ibalizumab care vizează receptorii CD4, o moleculă emergentă în terapia HIV. Front Microbiol. 2017;8:2323.
16. Emu B, Fessel J, Schrader S, et al. Studiu de fază 3 al ibalizumab pentru HIV-1 multidrog-rezistent. N Engl J Med. 2018;379:645-654.
17. Li Z, Zhou N, Sun Y, et al. Activitatea inhibitorului de atașare a HIV-1 BMS-626529, componenta activă a promedicamentului BMS-663068, împotriva virusurilor independente de CD4 și a învelișurilor HIV-1 rezistente la alți inhibitori de intrare. Antimicrob Agents Chemother. 2013:57(9):4172-4180.
18. Kozal M, Aberg J, Pialoux G. Fostemsavir la adulții cu infecție HIV-1 multirezistentă la medicamente. N Engl J Med. 2020;382(13):1232-1243.
19. Cahn P, Fink V, Patterson P. Fostemsavir: un nou inhibitor al atașamentului CD4. Curr Opin HIV AIDS. 2018;13(4):341-345.
20. Biktarvy (bictecgravir/emtricitabină/tenofovir alafenamidă) prospect. Foster City, CA: Gilead Sceinces, Inc; februarie 2018.
21. Gallant J, Lazzarin A, Mills M, et al. Bictegravir, emtricitabină și tenofovir alafenamidă versus dolutegravir, abacavir și lamivudină pentru tratamentul inițial al infecției cu HIV-1 (GS-US-380-1489): un studiu de non-inferioritate dublu-orb, multicentric, de fază 3, randomizat și controlat. Lancet. 2017;390(10107):2063-2072.
22. Sax PE, Pozniak A, Montes M, et al. Coformulat bictegravir, emtricitabină și tenofovir alafenamidă versus dolutegravir cu emtricitabină și tenofovir alafenamidă, pentru tratamentul inițial al infecției cu HIV-1 (GS-US-380-1490): un studiu randomizat, dublu-orb, multicentric, de fază 3, de non-inferioritate. Lancet. 2017;390(10107):2073-2082.
23. Malina JM, Ward D, Brar I, et al. Trecerea la bictegravir, emtricitabină și tenofovir alafenamidă în doză fixă de la dolutegravir plus abacavir șilamivudină la adulții cu HIV-1 cu supresie virologică: rezultatele la 48 de săptămâni ale unui studiu randomizat, dublu-orb, multicentric, controlat activ, de fază 3, de non-inferioritate. Lancet HIV. 2018;5(7):E357-E365.
24. Daar ES, De Jesus E, Ruane P, et al. Eficacitatea și siguranța trecerii la bictegravir, emtricitabină și tenofovir alafenamidă în doză fixă de la regimuri pe bază de inhibitori de protează potențați la adulții cu HIV-1 cu supresie virologică: rezultatele la 48 de săptămâni ale unui studiu randomizat, deschis, multicentric, multicentric, de fază 3, de non-inferioritate. Lancet HIV. 2018;5(7):e347-e356.
25. Prospectul Dovato (dolutegravir/lamivudină). Research Triangle Park, NC: GlaxoSmithKline. Martie 2020.
26. Scott LJ. Regimul cu un singur comprimat de dolutegravir/lamivudină: o revizuire în infecția cu HIV-1. Drugs. 2020;80(1):61-72.
27. Cahn P, Madero JS, Arribas JR, et al. Echipa de studiu GEMINI. Dolutegravir plus lamivudină versus dolutegravir plus tenofovir disoproxil fumarat de tenofovir și emtricitabină la adulții cu infecție HIV-1 care nu sunt infectați cu antiretrovirale (GEMINI-1 și GEMINI-2): rezultatele săptămânii 48 din două studii multicentrice, dublu-orb, randomizate, de non-inferioritate, de fază 3. Lancet. 2019;393(10167):143-155.
28. Mayer KH, Molina JM, Thompson MA, et al. Emtricitabină și tenofovir alafenamidă vs. emtricitabină și tenofovir disoproxil fumarat pentru profilaxia pre-expunere la HIV (DISCOVER): rezultate primare ale unui studiu de fază 3 randomizat, dublu-orb, multicentric, controlat activ, de non-inferioritate. Lancet. 2020;396(10246):239-254.
29. Hill A, Hughes SL, Gotham D, Pozniak AL. Tenofovir alafenamida versus tenofovir disoproxil fumarat: există o diferență reală în ceea ce privește eficacitatea și siguranța? J Virus Erad. 2018;4(2):72-79.