VIVO Fiziopatologie
Structura insulinei
Insulina este compusă din două lanțuri peptidice denumite lanțul A și lanțul B. Lanțurile A și B sunt legate între ele prin două legături disulfidice, iar în cadrul lanțului A se formează o disulfură suplimentară. La majoritatea speciilor, lanțul A este format din 21 de aminoacizi, iar lanțul B din 30 de aminoacizi.
Deși secvența de aminoacizi a insulinei variază între specii, anumite segmente ale moleculei sunt foarte bine conservate, inclusiv pozițiile celor trei legături disulfidice, ambele capete ale lanțului A și reziduurile C-terminale ale lanțului B. Aceste similitudini în secvența de aminoacizi a insulinei conduc la o conformație tridimensională a insulinei care este foarte asemănătoare între specii, iar insulina de la un animal este foarte probabil să fie biologic activă la alte specii. Într-adevăr, insulina de porc a fost utilizată pe scară largă pentru a trata pacienți umani.
Moleculele de insulină au tendința de a forma dimeri în soluție datorită legăturii de hidrogen între terminațiile C ale lanțurilor B. În plus, în prezența ionilor de zinc, dimerii de insulină se asociază în hexameri.
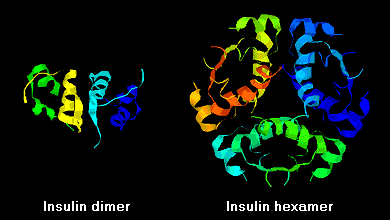
Aceste interacțiuni au ramificații clinice importante. Monomerii și dimerii difuzează cu ușurință în sânge, în timp ce hexamerii difuzează slab. Prin urmare, absorbția preparatelor de insulină care conțin o proporție mare de hexameri este întârziată și oarecum lentă. Acest fenomen, printre altele, a stimulat dezvoltarea unui număr de analogi de insulină recombinantă. Prima dintre aceste molecule care va fi comercializată – numită insulină lispro – este modificată astfel încât reziduurile de lizină și prolină de la capătul C-terminal al lanțului B sunt inversate; această modificare nu modifică legarea la receptor, dar minimizează tendința de a forma dimeri și hexameri.
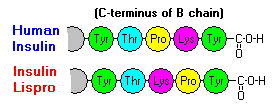 .
.