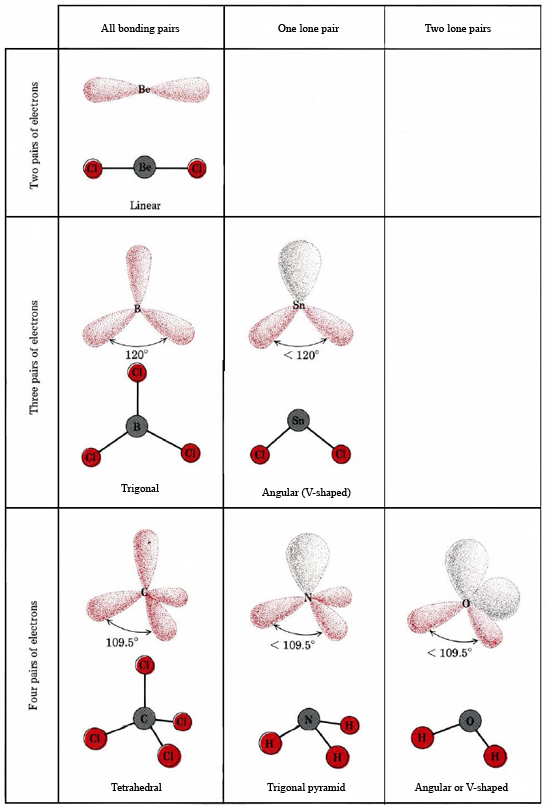
VSEPR-teorin kan förklara och förutsäga formerna hos molekyler som innehåller ensamma par. I ett sådant fall anses de ensamma paren liksom de bindande paren stöta bort och undvika varandra. Eftersom det till exempel finns två bindningar i SnCl2-molekylen kan man förvänta sig att den är linjär som BeCl2. Om vi ritar Lewisdiagrammet finner vi dock ett ensamstående par samt två bindningspar i Sn-atomens valensskal:
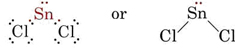_Chloride.jpg?revision=1&size=bestfit&width=235&height=48)
Ett ensamstående par påverkar också strukturen hos ammoniak, NH3. Eftersom denna molekyl lyder oktettregeln är N-atomen omgiven av fyra elektronpar:
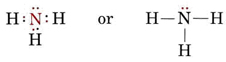
Om alla dessa par var likvärdiga skulle vi förvänta oss att vinkeln mellan dem skulle vara den regelbundna tetraedervinkeln 109,5°. Experimentellt har man funnit att vinkeln är något mindre, nämligen 107°. Återigen beror detta på att det ensamma paret är ”fetare” än de bindande paren och kan pressa dem närmare varandra.
Elektronstrukturen för H2O-molekylen liknar den för NH3 med undantag för att ett bindningspar har ersatts av ett ensamt par:
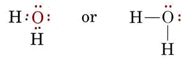
Exempel \(\PageIndex{1}\) : Molekylär geometri
Skissa och beskriv geometrin för följande molekyler: (a) GaCl3, (b) AsCl3 och (c) AsOCl3.
Lösning
a) Eftersom grundämnet gallium tillhör grupp III har det tre valenselektroner. Lewisdiagrammet för GaCl3 är således
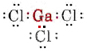
Då det finns tre bindningspar och inga ensamma par runt Ga-atomen, drar vi slutsatsen att de tre Cl-atomerna är trigonalt arrangerade och att alla fyra atomerna befinner sig i samma plan.
b) Arsenik tillhör grupp V och har därför fem valenselektroner. Lewisstrukturen för AsCl3 är således
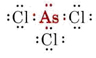
Då ett ensamstående par är närvarande är formen på denna molekyl en trigonal pyramid, med As-kärnan en bit ovanför en liksidig triangel av Cl-kärnor.
c) Lewisdiagrammet för AsOCl3 liknar det för AsCl3.

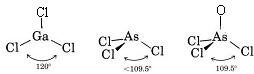
VSEPR-teorin kan också tillämpas på molekyler som innehåller fem och sex par valenceelektroner, varav några är ensamma par. Vi har inte inkluderat sådana arter här eftersom majoriteten av föreningarna faller in i de kategorier som vi har beskrivit.
Medverkande
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff och Adam Hahn.