Det kemiska grundämnet kobolt klassas som en övergångsmetall. Det upptäcktes 1735 av George Brandt.

Data Zone
| Klassificering: | Kobolt är en övergångsmetall |
| Färg: | blåvit |
| Atomvikt: | 58.9332 |
| Tillstånd: | fast |
| 1495 oC, 1768 K | |
| Skokpunkt: | |
| Protoner: | 27 |
| Neutroner i den vanligaste isotopen: | |
| Elektronskal: | |
| Elektronkonfiguration: | |
| Täthet vid 20oC: |
Visa mer: Värme, energi, oxidation, reaktioner,
föreningar, radier, ledningsförmåga
| Atomvolym: | |
| Struktur: | |
| Hårdhet: | |
| Specifik värmekapacitet | |
| Fusionsvärme | |
| Förbränningsvärme | |
| Förångningsvärme | 373.3 kJ mol-1 |
| 1:a joniseringsenergi | 758.4 kJ mol-1 |
| 2:a joniseringsenergi | 1646 kJ mol-1 |
| 3:a joniseringsenergi | 3232.2 kJ mol-1 |
| Elektronaffinitet | 63,8 kJ mol-1 |
| Minimalt oxidationsnummer | |
| Min. vanligt oxidationsnr. | 0 |
| Max. oxidationstal | 5 |
| Max. gemensam oxidationstal | 3 |
| Elektronegativitet (Paulingskala) | 1.88 |
| Polarisationsvolym | 7,5 Å3 |
| mild, w/ht ? Co3O4 | |
| Reaktion med 15 M HNO3 | starkt, ? Co(NO3)2, NOx |
| Reaktion med 6 M HCl | milt, ? H2, CoCl2 |
| Reaktion med 6 M NaOH | – |
| Hydrid(er) | Ingen |
| Klorid(er) | CoCl2 |
| Atomiskt radie | |
| Ionisk radie (1+ jon) | |
| Ionisk radie (2+ jon) | 83.8 pm |
| Ionisk radie (3+ jon) | |
| Ionisk radie (1-jon) | |
| Ionisk radie (3- jon) | |
| 17.9 x 106 S m-1 | |
| Frys-/smältpunkt: | 1495 oC, 1768 K |
Opptäckt av kobolt
Sedan urminnes tider har koboltföreningar använts för att producera blått glas och keramik.
Elementet isolerades först av den svenske kemisten George Brandt 1735. Han visade att det var närvaron av grundämnet kobolt som orsakade den blå färgen i glas, inte vismut som man tidigare trott.
Omkring 1741 skrev han: ”Liksom det finns sex sorters metaller, har jag också med tillförlitliga experiment visat … att det också finns sex sorters halvmetaller: en ny halvmetall, nämligen kobolt regulus utöver kvicksilver, vismut, zink och antimons och arsenikens regulus.”
Ordet kobolt härstammar från tyskans ”kobold”, som betyder troll eller alv. Bilden av kobolt nedan är av Ben Mills.


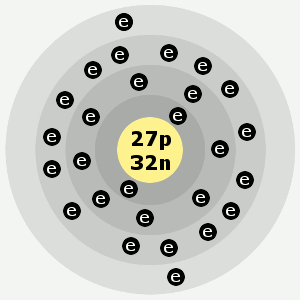
Kobalts elektronskal
Uppträdande och egenskaper
Skadliga effekter:
Kobolt och dess föreningar anses vara svagt giftiga vid hudkontakt och måttligt giftiga vid förtäring.
Kännetecken:
Kobolt är en blåvit, glänsande, hård och spröd metall. Den är ferromagnetisk.
Metallen är kemiskt aktiv och bildar många föreningar. Kobolt förblir magnetisk till den högsta temperaturen av alla magnetiska grundämnen (den har en Curiepunkt på 1121oC).
Användningsområden för kobolt
Kobolt används i legeringar för flygplansmotordelar och i legeringar med korrosions- och slitagebeständiga användningsområden.
Kobolt används ofta i batterier och vid galvanisering.
Kobaltsalter används för att ge glas och keramik blå och gröna färger.
Radioaktivt 60Co används vid behandling av cancer.
Kobolt är viktigt för många levande varelser och ingår i vitamin B12.
Kobolt används också i samarium-kobolt permanentmagneter. Dessa används i gitarrpickuper och höghastighetsmotorer.
Förkomst och isotoper
Förkomst jordskorpan: 25 viktdelar per miljon, 8 delar per miljon i mol
Förkomst solsystemet: 4 viktdelar per miljon, 0,7 moldelar per miljon
Kostnad, ren: 21 dollar per 100 g
Kostnad, bulk: 4,40 dollar per 100 g
Källa: Kobolt förekommer inte som fritt grundämne i naturen. Det finns i mineraliska malmer. De viktigaste malmerna av kobolt är kobaltit (CoAsS), erythrit (hydratiserad arsenat av kobolt), glaucodot (Co,Fe)AsS och skutterudit (Co,Ni)As3. Kobolt produceras i allmänhet som en biprodukt vid utvinning av nickel och koppar.
Isotoper: Kobolt har 22 isotoper vars halveringstider är kända, med masstal 50 till 72. Naturligt förekommande kobolt består av dess enda stabila isotop, 59Co.

- Edward Smedley, Hugh James Rose, Henry John Rose, Encyclopaedia Metropolitana; or Universal Dictionary of Knowledge .., 1845, Volume 4, p693 William Clowes and Sons.
Cite this Page
Cite this Page
För att länka på nätet, vänligen kopiera och klistra in något av följande:
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt</a>
eller
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt Element Facts</a>
För att citera denna sida i ett akademiskt dokument, vänligen använd följande MLA-kompatibla citation:
"Cobalt." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cobalt.html>.
.