Chemický prvek chlor je klasifikován jako halogen a nekov. Byl objeven v roce 1774 Carlem Wilhelmem Scheelem.

Datová zóna
| Klasifikace: | Chlor je halogen a nekov |
| Barva: | zelenožlutá |
| Atomová hmotnost: | 35.453 |
| Stav: | plyn |
| Teplota tání: | -101 oC , 172 K |
| Teplota varu: | -34 oC , 239 K |
| Elektrony: | 17 |
| Protony: | 17 |
| Neutrony v nejhojnějším izotopu: | 18 |
| Elektronové obaly: | 2,8,7 |
| Elektronová konfigurace: | 1s2 2s2 2p6 3s2 3p5 |
| Hustota při 20oC: | 0.003214 g/cm3 |
Zobrazit více, včetně: Sloučeniny, poloměry, vodivosti
| Atomový objem: | 22,7 cm3/mol |
| Struktura: | vrstvy Cl2 v pevné látce |
| Tvrdost: | |
| Specifická tepelná kapacita | 0,48 J g-1 K-1 |
| Tavné teplo | 6. Jaká je hmotnost Cl2?406 kJ mol-1 Cl2 |
| Teplota atomizace | 122 kJ mol-1 |
| Teplota vypařování | 20.41 kJ mol-1 Cl2 |
| 1. ionizační energie | 1251,1 kJ mol-1 |
| 2. ionizační energie | 2297.3 kJ mol-1 |
| 3. ionizační energie | 3821.8 kJ mol-1 |
| Elektronová afinita | 349 kJ mol-1 |
| Minimální oxidační číslo | -1 |
| Min. běžné oxidační číslo | -1 |
| Maximální oxidační číslo | 7 |
| Maximální běžné oxidační číslo. | 7 |
| Elektronegativita (Paulingova stupnice) | 3,16 |
| Polarizační objem | 2.2 Å3 |
| Reakce se vzduchem | žádná |
| Reakce s 15 M HNO3 | mírná, ⇒ HClOx, NOxCl, NOx |
| Reakce s 6 M HCl | mírná, ⇒ HOCl, Cl- |
| Reakce s 6 M NaOH | mírná, ⇒ OCl-, Cl- |
| Oxid(y) | Cl2O, ClO2, Cl2O7 |
| Hydrid(y) | HCl |
| Chlorid(y) | Cl2 |
| Atomový poloměr | 100 pm |
| Iontový poloměr (1+ ion) | – |
| Iontový poloměr (2+ ion) | – |
| Iontový poloměr (3+ ion) | – |
| Iontový poloměr (1- ion) | 167 pm |
| Iontový poloměr (2- ion) | – |
| Iontový poloměr (3- ion) | – |
| Tepelná vodivost | 0.0089 W m-1 K-1 |
| Elektrická vodivost | – |
| Teplota tuhnutí/topení: | -101 oC , 172 K |

Chlor ve zkumavce (foto: Ben Mills)
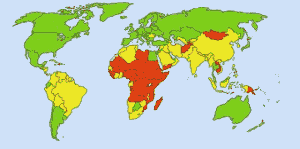
Bezpečná pitná voda: Obr: Ionut_Cojocaru. V zelených oblastech se každý může dostat k nezávadné vodě. V červených oblastech se k upravené vodě nedostane nejméně 25 procent lidí. Žluté oblasti jsou přechodné. Před rutinním používáním chlóru v amerických vodovodech si břišní tyfus vyžádal 25 000 úmrtí ročně. Dnes je 98 % veřejných vodovodů upravováno chlorem nebo sloučeninou chloru. Břišní tyfus si nyní vyžádá v průměru asi jednu oběť ročně. (4)

Carl Wilhelm Scheele, který v roce 1774 objevil chlor.
Objevení chloru
Chlor poprvé vyrobil v roce 1774 Carl Wilhelm Scheele ve Švédsku. Scheele shromáždil plyn uvolněný reakcí pyrolusitu se spiritus salis – alchymistický termín znamenající duch/dech soli. Nový plyn měl podle Scheeleho „velmi znatelný dusivý zápach, který nejvíce tísní plíce… a dodává vodě mírně kyselou chuť… vzduch v ní získává žlutou barvu…“. (1)
Scheele také zaznamenal vysokou reaktivitu a bělicí vlastnosti nového plynu, který vyrobil: „…všechny kovy byly napadeny… pevná zásada se přeměnila na kuchyňskou sůl… všechny rostlinné květy – červené, modré a žluté – v krátké době zbělely; totéž se stalo i se zelenými rostlinami… hmyz okamžitě uhynul. (1)
Navzdory přesnosti svých pozorování se Scheele mylně domníval, že nový plyn je deflostigovaná forma kyseliny muriové.
Slavný francouzský chemik Antoine Lavoisier se domníval, že nový plyn by se měl nazývat kyselina oxymuriová podle dosud neobjeveného prvku murium. (2)
* Zmatek ohledně skutečné identity chloru způsobila flogistonová teorie; flogiston byl chemiky přijímán po většinu 17. století – dokud jej sám Lavoisier nevyvrátil. Flogiston byl „látkou“ používanou k vysvětlení tehdy nevysvětlitelného. Příhodně měla zápornou hmotnost, když bylo třeba, a „vysvětlovala“ reakce, jako je rezavění a hoření.
Lavoisier byl strůjcem pádu flogistonu, když ukázal, že chemie kyslíku je v chemických reakcích lepším vysvětlením než flogiston. (3)
Do roku 1810 panoval vědecký konsenzus, že prvek, který dnes nazýváme chlór, je ve skutečnosti sloučenina, která obsahuje kyslík. Anglický chemik sir Humphry Davy zjistil, že konsensus je mylný; nepodařilo se mu přimět nový žlutozelený plyn k reakci s elektrodou z dřevěného uhlí, což ho vedlo k domněnce, že možná neobsahuje kyslík. V reakcích s fosforem a amoniakem prokázal, že nový plyn kyslík neobsahuje. Použil obrovskou voltaickou hromadu s 2000 deskami, aby zjistil, zda může získat kyslík ze sloučenin fosforu a síry v plynu, ale opět žádný kyslík nenašel. (1a)
V roce 1811 Davy dospěl k závěru, že nový plyn je ve skutečnosti nový prvek. (1b) Pojmenoval jej chlor, z řeckého slova „chloros“, což znamená bledě zelený nebo žlutozelený.
Zajímavá fakta o chloru
- První objevená řetězová reakce nebyla jadernou reakcí; byla to chemická řetězová reakce. Objevil ji v roce 1913 Max Bodenstein, který viděl, jak směs plynného chlóru a vodíku po spuštění světlem exploduje. Mechanismus řetězové reakce plně vysvětlil v roce 1918 Walther Nernst.
- Zemské oceány obsahují velké množství chlóru. Kdyby se tento chlor uvolnil jako plyn, jeho hmotnost by byla 5x větší než celková hmotnost současné zemské atmosféry. (Naše oceány obsahují asi 2,6 x 1016 metrických tun chlóru, většinou ve formě chloridu sodného.)
- Chlor se vyskytuje hojně nejen v našich oceánech; je to šestý nejrozšířenější prvek v zemské kůře.
- Vystavení malému množství chlóru, i krátkodobé, může být smrtelné. Smrtelné následky se očekávají již při koncentraci 1 dílu chloru v tisícině vzduchu (nebo někdy i při ještě nižších koncentracích). (5)
- Chlor je těžší než vzduch. Při uvolnění vytváří jedovatou přikrývku, která je unášena větrem. Chlor byl použit jako chemická zbraň v první světové válce, nejprve v roce 1915 německou armádou a poté západními spojenci. Nebyla tak „účinná“, jak se doufalo, protože chlor je snadno odhalitelný díky svému silnému zápachu. Je také rozpustný ve vodě, a tak se vojáci mohli chránit před jeho nejhoršími účinky dýcháním přes vlhké látky.

Vzhled a vlastnosti
Škodlivé účinky:
Chlor je toxický plyn, který dráždí kůži, oči a dýchací cesty.
Charakteristika:
Chlor je zelenožlutý, dvouatomový, hustý plyn s ostrým zápachem (zápach bělidla).
V přírodě se volně nevyskytuje, protože se snadno slučuje s téměř všemi ostatními prvky.
Chlor se v přírodě vyskytuje především jako kuchyňská sůl (NaCl), karnalit , a sylvit (KCl).
V kapalném i pevném skupenství je silným bělicím, oxidačním a dezinfekčním činidlem.
Použití chloru
Chlor se používá k výrobě nezávadné pitné vody.
Chlorované sloučeniny se používají především v hygienických zařízeních, při bělení celulózy, jako dezinfekční prostředky a při zpracování textilu.
Chlór se také používá k výrobě chlorečnanů a je důležitý v organické chemii, kde tvoří sloučeniny, jako je chloroform, tetrachlormethan, polyvinylchlorid a syntetický kaučuk.
Mezi další využití sloučenin chlóru patří barviva, ropné produkty, léky, antiseptika, insekticidy, potraviny, rozpouštědla, barvy a plasty.
Výskyt a izotopy
Výskyt v zemské kůře: 145 hmotnostních dílů na milion, 85 molů na milion
Výskyt ve sluneční soustavě: 8 hmotnostních dílů na milion, 0,3 molů na milion
Cena, čistý: 0,15 $ na 100 g
Cena, volně ložený: $ na 100 g
Zdroj: Plynný chlor se komerčně vyrábí elektrolýzou chloridu sodného (NaCl) z mořské vody nebo solanky ze solných dolů.
Izotopy: Chlor má 16 izotopů s hmotnostními čísly 31 až 46, jejichž poločasy rozpadu jsou známy. Přirozeně se vyskytující chlor je směsí svých dvou stabilních izotopů 35Cl a 37Cl s přirozeným zastoupením 75,8 % a 24,3 %.

- Henry M. Leicester, Herbert S. Klickstein, A Source Book in Chemistry, 1400-1900. (1969) Harvard University Press. s111; 1a. s241.; 1b. s257.
- J.W. Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry. 1922, vol. 2, Longmans, Green and Co. s. 21.
- Antoine Lavoisier, Memoires de l‘ Academie royale des sciences 1783. 1786, s. 505-538.
- The Chlorine Tree.
- OSHA, Pokyny pro bezpečnost a ochranu zdraví při práci s chlorem.
Citujte tuto stránku
Pro online odkazování zkopírujte a vložte jednu z následujících možností:
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine</a>
nebo
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine Element Facts</a>
Chcete-li tuto stránku citovat v akademickém dokumentu, použijte následující citaci v souladu s MLA:
"Chlorine." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/chlorine.html>.
.