ABSTRAKT: Dostupné antiretrovirové (ARV) léky pro léčbu HIV se od roku 2018 rozšířily. Byly schváleny nové typy ARV s novými mechanismy účinku, včetně ibalizumabu-uiyk a fostemsaviru. Došlo také ke schválení kombinovaných tablet dříve dostupných léků, jako je bictegravir/emtricitabin/tenofovir alafenamid a dolutegravir/lamivudin. V neposlední řadě došlo k rozšíření schválených indikací samotných dříve dostupných antiretrovirových léků, jako je emtricitabin/tenofovir alafenamid pro použití v preexpoziční profylaxi.
US Pharm. 2020:45(10):17-25.
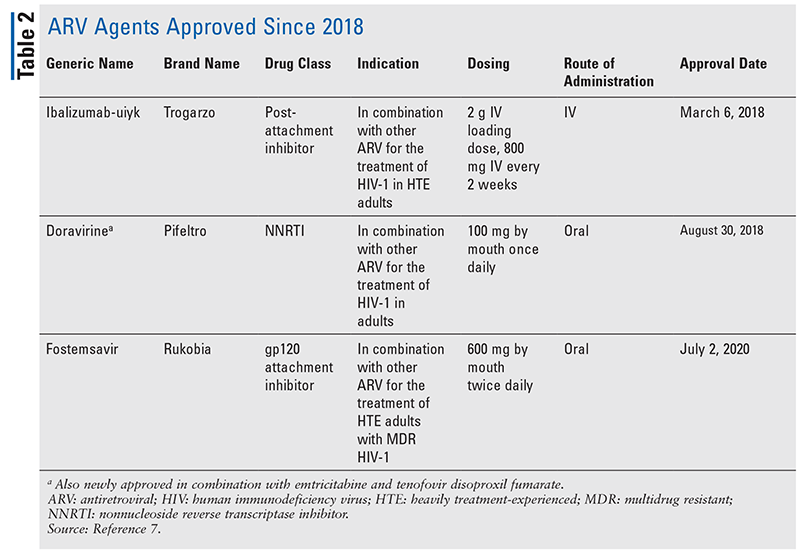
Základní antiretrovirové (ARV) přípravky pro léčbu HIV se po léta skládaly převážně ze stejné hrstky tříd léčiv. Léčba HIV byla nejprve zkoušena pomocí nukleosidových inhibitorů reverzní transkriptázy (NRTI), první třídy antiretrovirových léků schválených úřadem FDA. Postupně byly objevovány další a další třídy, které byly k dispozici pro léčbu v různých, často složitých režimech (TABULKA 1).1-3 Po schválení raltegraviru v roce 2007 se schválení nových léků na HIV týkala převážně repurpovaných dostupných léků a nových kombinovaných léků. To se změnilo v roce 2018, kdy byl schválen ibalizumab-uiyk, první nový antiretrovirový lék po více než deseti letech.4 Ibalizumab-uiyk byl rychle následován novým nenukleosidovým inhibitorem reverzní transkriptázy (NNRTI), doravirinem, později téhož roku a novým inhibitorem vazby, fostemsavirem, v roce 2020 (TABULKA 2).5-7
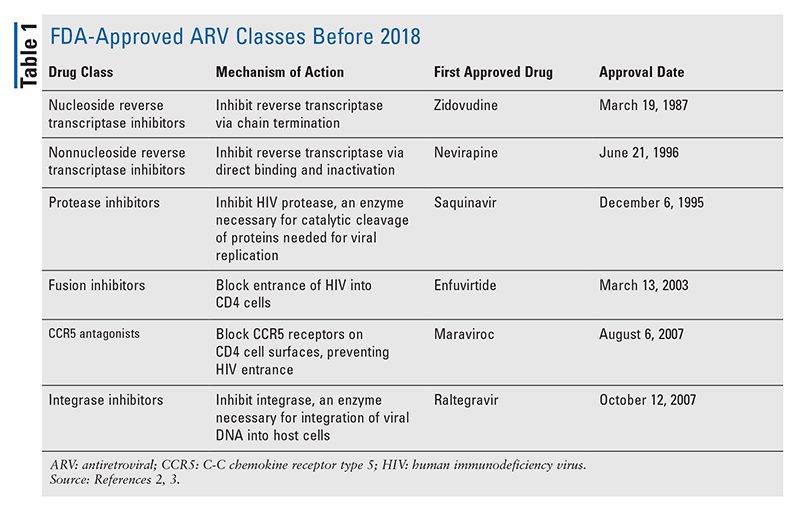
Přestože nová léčiva jsou často nejzajímavějšími novými schváleními léků, ARV se zlepšila i v jiných směrech. Vzhledem k obrovské tabletové zátěži mnoha režimů HIV mohou nově schválené kombinované antiretrovirové léky (TABULKA 3) pacientům výrazně usnadnit život. Používání takových přípravků a omezení nezbytné tabletové zátěže prokázalo lepší adherenci a celkové výsledky.8,9 Došlo také k rozšíření schválených indikací u dříve dostupných ARV (TABULKA 4), což nabízí nové možnosti pro určité skupiny pacientů a indikace.10-14
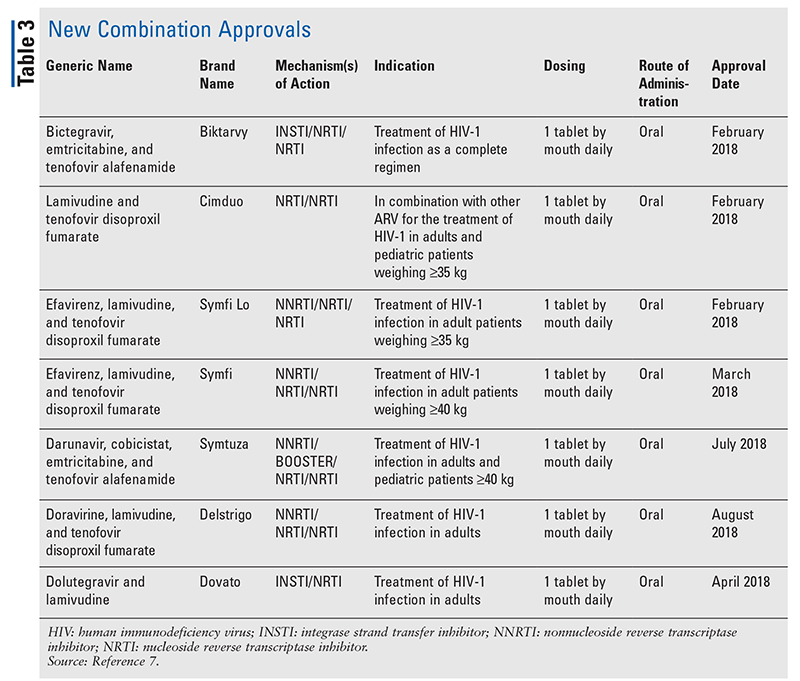
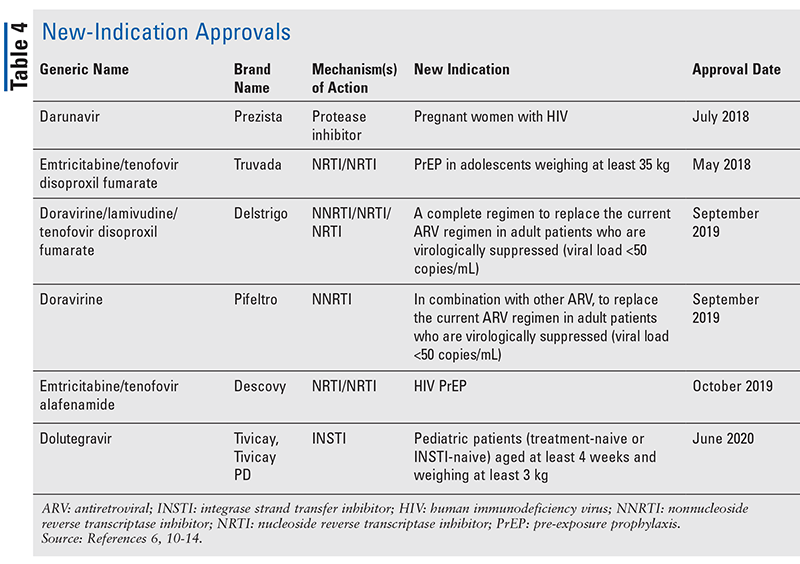
Přestože od roku 2018 došlo k mnoha novým schválením, tento článek profiluje čtyři nově schválené léky a jednu novou indikaci. Tato schválení byla vybrána tak, aby demonstrovala vzorek široké škály nových látek, které se stávají dostupnými, a také zdůraznila některé nové možnosti, které nabízejí jedinečnou příležitost v léčbě HIV.
Ibalizumab-Uiyk (Trogarzo)
Ibalizumab-uiyk je injekční rekombinantní monoklonální protilátka, která se váže na povrchové proteiny buněk CD4, což vede ke konformačním změnám, které zabraňují krokům po připojení, jež jsou nutné pro fúzi HIV-1 a vstup do buňky. Jedná se o jediný monoklonální lék používaný při léčbě HIV. Díky své jedinečné vazebné specifitě blokuje ibalizumab-uiyk vstup viru, aniž by způsoboval imunosupresi, což je problém u mnoha monoklonálních léků.4,15 Je indikován v kombinaci s jinými antiretrovirovými léky k léčbě těžce léčených (HTE) dospělých s multirezistentním (MDR) HIV-1, u kterých selhává současný režim antiretrovirové léčby.4
Schválení přípravku ibalizumab-uiyk bylo založeno na studii provedené na 40 HTE pacientech s HIV s virovou náloží vyšší než 1 000 kopií/ml a dokumentovanou rezistencí na alespoň jeden NRTI, NNRTI a inhibitor proteázy. U pacientů se rovněž vyžadovalo, aby byli léčeni nejméně 6 měsíců a aby u nich nedávno selhala léčba. Studie zahrnovala tři období, počínaje šestidenním obdobím, kdy byla stanovena a potvrzena výchozí virová nálož (kontrolní období). Sedmý den obdrželi pacienti kromě standardního režimu ART také zaváděcí dávku ibalizumabu-uiyk v dávce 2 000 mg (období funkční monoterapie). Ve 14. dni byla znovu vyhodnocena virová zátěž a byly sledovány a upravovány režimy, aby byla zajištěna správná aktivita proti jejich HIV infekci. Ibalizumab-uiyk 800 mg byl podáván intravenózně každé 2 týdny až do ukončení studie (udržovací období). Primární koncový ukazatel hodnotil rozdíl v podílu poklesu virové nálože od kontrolního období do období funkční monoterapie, konkrétně porovnával procento pacientů s poklesem celkové virové nálože o ³0,5 log10. V kontrolním období byl takový pokles zjištěn u 3 % pacientů, zatímco v období funkční monoterapie dosáhlo uvedeného poklesu virové zátěže 83 % pacientů. Na konci 25 týdnů dosáhlo 43 % pacientů virové nálože <50 kopií/ml.16
Na základě této studie je schválené dávkování ibalizumabu-uiyk jednorázová intravenózní plnící dávka 2 000 mg, po které následuje udržovací intravenózní dávka 800 mg každé 2 týdny.4,16 Po dobu 1 hodiny po podání první infuze je nutné pečlivé monitorování kvůli reakcím souvisejícím s infuzí, přičemž následné monitorování infuze se zkracuje na 15 minut po toleranci úvodní dávky.4 Zdá se, že ibalizumab-uiyk je jinak dobře snášen; nejčastějšími nežádoucími účinky spojenými s ibalizumab-uiykem byly nevolnost, závratě a průjem.4,16
Fostemsavir (Rukobia)
Fostemsavir je nový antiretrovirový lék indikovaný ke kombinované léčbě u dospělých HTE se známou MDR HIV-1, konkrétně u pacientů, u kterých selhává současná ART z důvodu možné rezistence, intolerance nebo bezpečnostních důvodů.4 Jedná se o první inhibitor attachmentu schválený FDA. Po enzymatické aktivaci na aktivní molekulu temsavir se váže na gp120, virový obalový glykoprotein nezbytný pro přichycení viru na buňky CD4. Tím zabrání vstupu viru do buněk CD4 a účinně zastaví virovou replikaci. Díky tomuto novému mechanismu je nepravděpodobné, že by fostemsavir vyvolal rezistenci vůči sobě samému prostřednictvím selekčního tlaku spojeného s většinou ostatních antiretrovirových léků.6,17
Fostemsavir byl hodnocen z hlediska bezpečnosti i účinnosti v randomizované, dvojitě zaslepené, placebem kontrolované klinické studii (BRIGHTE) zahrnující 371 pacientů s HTE HIV-1.16,17 Pacienti v hlavní kohortě byli léčeni jak svým základním režimem ART spolu s fostemsavirem 600 mg dvakrát denně, tak placebem po dobu celkem 8 dní. Při hodnocení 8. dne vykazovali pacienti užívající fostemsavir významně nižší sérové hladiny virové HIV-RNA. Po tomto počátečním období léčby byli všichni pacienti převedeni na léčbu fostemsavirem 600 mg dvakrát denně. Po 24 týdnech dosáhlo 53 % účastníků studie účinné nedetekovatelné hladiny virové suprese, přičemž v 96. týdnu se suprese zlepšila na 60 %.17,18
Nejčastěji hlášeným nežádoucím účinkem fostemsaviru byla nevolnost. Závažnější reakce včetně zvýšení jaterních enzymů byly hlášeny u pacientů s koinfekcí hepatitidou B nebo C.17,18 V dalších studiích byl hlášen menší výskyt bolesti hlavy, vyrážky a průjmu. Aktivní metabolit temsaviru je metabolizován CYP3A4, proto je třeba se vyhnout silným induktorům, jako je karbamazepin, rifampicin a třezalka tečkovaná, aby se zabránilo snížení sérové koncentrace temsaviru.17-19
Bictegravir/Emtricitabin/TenofovirAlafenamid (Biktarvy)
Bictegravir/emtricitabin/tenofovir alafenamid (BIC/FTC/TAF) je kombinovaná tableta s fixní dávkou, která se podává jednou denně a obsahuje nový inhibitor integrázy a dva nukleosidové/nukleotidové inhibitory reverzní transkriptázy. Jednotlivé složky přípravku Biktarvy jsou bictegravir 50 mg (inhibitor přenosu vláken integrázy ), emtricitabin 200 mg (NRTI) a tenofovir alafenamid 25 mg (NRTI). BIC/FTC/TAF je indikován jako kompletní režim u dospělých infikovaných HIV-1 bez anamnézy ART nebo jako náhrada současného ART režimu u pacientů, kteří jsou virologicky suprimováni (virová nálož £50 kopií na ml) na stabilním ARV režimu po dobu nejméně 3 měsíců a nemají v anamnéze selhání léčby nebo rezistenci na jeho jednotlivé složky. Nejvýznamnější je, že se jedná o kompletní režim v jedné tabletě, který nevyžaduje žádné další antiretrovirové léky.20
BIC/FTC/TAF byl schválen v roce 2018 po čtyřech klinických studiích. Dvě z těchto klinických studií testovaly účinnost a bezpečnost BIC/FTC/TAF u pacientů bez anamnézy ART: Studie 1489 (randomizovaná, BIC/FTC/TAF vs. abakavir/ dolutegravir/lamivudin a studie 1490 (randomizovaná, BIC/FTC/TAF vs. dolutegravir + emtricitabin/tenofovir alafenamid ).21,22 Ve studii 1489 bylo primárního cílového ukazatele virové nálože <50 kopií/ml dosaženo u 92 % skupiny BIC/FTC/TAF a 93 % skupiny ABC/DTG/3TC (rozdíl v léčbě -0,6 %; 95% interval spolehlivosti , -4,8 % až 3,6 %). Ve studii 1490 bylo primárního cílového ukazatele virové nálože <50 kopií/ml dosaženo u 89 % skupiny BIC/FTC/TAF a 93 % skupiny DTG + FTC/TAF (rozdíl v léčbě -3,5 %; 95% CI, -7,9 % až 1,0 %).21,22
Další dvě studie testovaly účinnost a bezpečnost BIC/FTC/TAF u virologicky suprimovaných pacientů, kteří by byli převedeni ze svých současných ART režimů na BIC/FTC/TAF: Studie 1844 (randomizovaná, přechod z dolutegraviru plus abakavir/lamivudin nebo ABC/DTG/3TC na BIC/FTC/TAF) a studie 1878 (otevřená, přechod z atazanaviru nebo boostovaného darunaviru plus abakavir/emtricitabin nebo emtricitabin/tenofovir disoproxil fumarát na BIC/FTC/TAF).23,24 Ve studii 1844 byl primární koncový ukazatel pacientů, kteří ztratili stav virologické suprese (virová nálož ³50 kopií na ml), pozorován u 1 % skupiny BIC/FTC/TAF a <1 % skupiny s původním režimem (rozdíl v léčbě 0,7 %, 95% CI, -1,0 % až 2,8 %). Ve studii 1878 byl primární koncový ukazatel pacientů, kteří ztratili stav virologické suprese, pozorován u 2 % skupiny BIC/FTC/TAF a 2 % skupiny s původním režimem (rozdíl v léčbě 0,0 %; 95% CI, -2,5 % až 2,5 %).23,24
BIC/FTC/TAF se dávkuje jednou denně ústy s jídlem nebo bez jídla. Nejčastěji hlášenými nežádoucími účinky pozorovanými u pacientů byly průjem, nevolnost a bolest hlavy.20-24
Dolutegravir/lamivudin (Dovato)
Kombinace dolutegravir/lamivudin (DTG/3TC), INSTI a NRTI, byla schválena v roce 2019. Jedná se o první kompletní režim se dvěma léky s fixní dávkou pro léčbu infekce HIV-1 u dospělých pacientů, kteří nejsou léčeni. To kontrastuje s tradičně vyžadovanými třemi léky v rámci standardních možností léčby. To může nabídnout příležitost u pacientů, kteří nemohou tolerovat žádný z běžnějších třílékových režimů z důvodu nežádoucích účinků nebo nevyhnutelných lékových interakcí.25,26
Účinnost a bezpečnost kombinace dolutegravir/lamivudin byla prokázána ve dvou identických studiích, GEMINI-1 a GEMINI-2. V obou studiích byla použita kombinace dolutegravir/lamivudin.27 Do těchto studií bylo zařazeno celkem 1 433 dospělých osob infikovaných virem HIV-1 a neléčených, které byly randomizovány k užívání režimu se dvěma léky, dolutegravir 50 mg plus lamivudin 150 mg, nebo režimu se třemi léky, dolutegravir plus emtricitabin plus tenofovir disoproxil fumarát. Primární cílový ukazatel dosažení virové nálože <50 kopií/ml ukázal, že DTG/3TC je noninferiorní – 91 % ze 716 pacientů užívajících dva léky a 93 % ze 717 pacientů užívajících tři léky (rozdíl v léčbě -1,7 %; 95% CI, -4,4 % až 1,1 %) – když byly výsledky obou studií sloučeny dohromady. Souhrnné studie také ukázaly, že početně méně pacientů mělo nežádoucí příhody související s léčbou v režimu se dvěma léky v porovnání s režimem se třemi léky (126 ze 716, resp. 169 ze 717 pacientů). Vzhledem k nehorší účinnosti a podobnému profilu snášenlivosti mohlo Ministerstvo zdravotnictví a sociálních služeb zařadit fixní dávku kombinovaného DTG/3TC do pokynů pro léčbu HIV/AIDS jako doporučený počáteční režim pro většinu osob s HIV.27
Kombinace dolutegravir/lamivudin se dávkuje jednou denně ústy s jídlem nebo bez jídla. Nejčastějšími nežádoucími účinky pozorovanými u pacientů jsou bolest hlavy, nevolnost, průjem, únava a nespavost. Přestože se jedná o kombinovanou tabletu se dvěma léky, není nutné ji podávat s dalšími antiretrovirovými léky, protože se jedná o kompletní léčebný režim.25-27
Emtricitabin/Tenofovir Alafenamid pro preexpoziční profylaxi (PrEP)
Od roku 2012 byl jedinou možností schválenou FDA pro PrEP FTC/ TDF.11 To se změnilo v roce 2019, kdy byla schválena kombinace emtricitabin/tenofovir alafenamid (FTC/TAF),13 strukturálně podobný kombinovaný lék. Ten je nyní indikován k použití v rámci PrEP u neinfikovaných pacientů s vysokým rizikem přenosu HIV pohlavním stykem. To vylučuje pacienty ohrožené receptivním vaginálním stykem, protože tato populace dosud nebyla hodnocena.
Schválení PrEP vychází z nedávné studie DISCOVER, randomizované dvojitě zaslepené studie srovnávající FTC/TAF se standardně užívaným FTC/TDF při snižování rizika získání infekce HIV-1 u mužů a transsexuálních žen, kteří mají sex s muži a jsou ohroženi infekcí HIV-1.7 Studie byla provedena jako randomizovaná, dvojitě zaslepená studie s paralelními skupinami s minimální dobou sledování 48 týdnů, přičemž nejméně 50 % účastníků mělo po randomizaci 96 týdnů sledování. Bylo do ní zařazeno 5 399 účastníků, kteří byli randomizováni v poměru 1:1 do jedné ze skupin. Primárním cílem studie bylo posoudit výskyt infekce HIV-1 na 100 osoboroků. Mezi 2 694 účastníky v rameni FTC/TAF byl výskyt HIV-1 zaznamenán u 7 pacientů (0,16/100 osoboroků). Mezi 2 693 účastníky v rameni FTC/TDF byl výskyt HIV-1 zaznamenán u 15 pacientů (0,34/100 osoboroků). Tyto incidence ukazují, že FTC/TAF nebyl horší než FTC/TDF u účastníků studie, kteří byli vystaveni riziku nákazy HIV, a nakonec umožnily úřadu FDA přidat PrEP do indikací pro FTC/TAF.13
Místo FTC/TAF v terapii HIV je pravděpodobně stále nejasné. I když našel uplatnění v jiných oblastech léčby HIV, jeho přínos oproti alternativě v tomto prostředí ještě nebyl jednoznačně stanoven. Ačkoli je TAF podobný, může nabídnout nižší výskyt změn hustoty kostí a renální dysfunkce, nežádoucích účinků spojených s TDF. Tento rozdíl však není dobře prokázán, přičemž některé údaje naznačují, že v režimech, které nezahrnují farmakokinetický posilovač, jako je kobicistat nebo ritonavir, nemusí být tento přínos klinicky významný. 27-29
Závěr
Vzhledem ke složitosti viru HIV a jeho potenciální rezistenci se může antiretrovirová léčba stát pro pacienty rychle zatěžující. Od roku 2018 do současnosti zaznamenala lékařská komunita široký rozmach antiretrovirové terapie schválené úřadem FDA pro léčbu HIV. Tyto terapie zahrnují nové kombinované tablety s pevnou dávkou, nové léky, které působí jinými mechanismy než ty, které byly na trhu dříve, a dokonce i nové indikace pro dříve existující léky. Tyto nové léky již ovlivnily současná léčebná doporučení a mohou pomoci pacientům žít delší a zdravější život.
Obsah obsažený v tomto článku má pouze informativní charakter. Obsah nemá sloužit jako náhrada odborného poradenství. Spoléhání se na jakékoli informace uvedené v tomto článku je pouze na vaše vlastní riziko.
1. Vella S, Schwartländer B, Sow SP, et al. Historie antiretrovirové terapie a jejího zavádění v oblastech světa s omezenými zdroji. AIDS. 2012;26(10):1231-1241.
2. Arts EJ, Hazuda DJ. Antiretrovirová léčba HIV-1. Cold Spring Harb Perspect Med. 2012;2(4):a007161.
3. Chaudhuri S, Symons JA, Deval J. Innovation and trends in the development and approval of antiviral medicines: 1987-2017 a dále. Antiviral Res. 2018;155:76-88.
4. Trogarzo (ibalizumab-uiyk) příbalová informace. Montreal, Quebec: Theratechnologies Inc; březen 2018.
5. Příbalová informace přípravku Pifeltro (doravirin). Whitehouse Station, New Jersey: Merck & Co, Inc; březen 2019.
6. Rukobia (fostemsavir) příbalová informace. Research Triangle Park, NC: GlaxoSmithKline; červenec 2020.
7. Pan F, Chernew ME, Fendrick AM. Vliv kombinovaných léčivých přípravků s pevnou dávkou na adherenci k předepsaným lékům. J Gen Intern Med. 2008;23(5):611-614.
8. Verma AA, Khuu W, Tadrous M,et al. Fixed-dose combination antihypertensive medications, adherence, and clinical outcomes: a population-based retrospective cohort study. PLoS Med. 2018;15(6):e1002584.
9. Národní ústavy zdraví. HIVinfo. FDA-approved HIV medicines. hivinfo.nih.gov/understanding-hiv/fact-sheets/fda-approved-hiv-medicines. Přístup 22. září 2020.
10. Příbalová informace přípravku Prezista (darunavir). Titusville, NJ: Janssen Therapeutics; květen 2019.
11. Truvada (emtricitabin/tenofovir disoproxil fumarát) příbalová informace. Foster City, Kalifornie: Gilead Sciences, Inc; červen 2004/2020.
12. Delstrigo (doravirin/lamivudin/tenofovir disproxil fumerát) příbalová informace. White House Starion, NJ: Merck & Co, Inc; srpen 2018.
13. Descovy (emtricitabin/tenofovir alafenamid) příbalová informace. Foster City, Kalifornie: Gilead Sciences, Inc; prosinec 2019.
14. Tivicay (dolutegravir) příbalová informace. Research Triangle Park, NC. GlaxoSmithKline; červen 2020.
15. Iacob SA, Iacob DG. Ibalizumab zaměřený na receptory CD4, nová molekula v terapii HIV. Front Microbiol. 2017;8:2323.
16. Emu B, Fessel J, Schrader S, et al. Studie fáze 3 ibalizumabu u multirezistentního HIV-1. N Engl J Med. 2018;379:645-654.
17. Li Z, Zhou N, Sun Y, et al. Activity of the HIV-1 attachment inhibitor BMS-626529, the active component of the prodrug BMS-663068, against CD4-independent viry and HIV-1 envelopes resistant to other entry inhibitors. Antimicrob Agents Chemother. 2013:57(9):4172-4180.
18. Kozal M, Aberg J, Pialoux G. Fostemsavir u dospělých s multirezistentní infekcí HIV-1. N Engl J Med. 2020;382(13):1232-1243.
19. Cahn P, Fink V, Patterson P. Fostemsavir: nový inhibitor vazby na CD4. Curr Opin HIV AIDS. 2018;13(4):341-345.
20. Příbalová informace přípravku Biktarvy (bictecgravir/emtricitabin/tenofovir alafenamid). Foster City, Kalifornie: Gilead Sceinces, Inc; únor 2018.
21. Gallant J, Lazzarin A, Mills M, et al. Bictegravir, emtricitabin a tenofovir alafenamid versus dolutegravir, abakavir a lamivudin pro počáteční léčbu infekce HIV-1 (GS-US-380-1489): dvojitě zaslepená, multicentrická, randomizovaná kontrolovaná studie fáze 3 s non-inferioritou. Lancet. 2017;390(10107):2063-2072.
22. Sax PE, Pozniak A, Montes M, et al. Coformulated bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir with emtricitabine and tenofovir alafenamide, for initial treatment of HIV-1 infection (GS-US-380-1490): a randomomised, double-blind, multicentre, phase 3, non-inferiority trial. Lancet. 2017;390(10107):2073-2082.
23. Malina JM, Ward D, Brar I, et al. Přechod na fixní dávku bictegraviru, emtricitabinu a tenofovir alafenamidu z dolutegraviru plus abakaviru alamivudinu u virologicky suprimovaných dospělých s HIV-1: 48týdenní výsledky randomizované, dvojitě zaslepené, multicentrické, aktivně kontrolované studie fáze 3, non-inferiority. Lancet HIV. 2018;5(7):E357-E365.
24. Daar ES, De Jesus E, Ruane P, et al. Efficacy and safety of switching to fixed-dose bictegravir, emtricitabine, and tenofovir alafenamide from boosted protease inhibitor-based regimens in virologically suppressed adults with HIV-1: 48-week results of a randomized, open-label, multicentre, phase 3, non-inferiority trial. Lancet HIV. 2018;5(7):e347-e356.
25. Příbalová informace přípravku Dovato (dolutegravir/lamivudin). Research Triangle Park, NC: GlaxoSmithKline. Březen 2020.
26. Scott LJ. Režim dolutegravir/lamivudin v jedné tabletě: přehled u infekce HIV-1. Léčiva. 2020;80(1):61-72.
27. Cahn P, Madero JS, Arribas JR a další: Tým studie GEMINI. Dolutegravir plus lamivudin versus dolutegravir plus tenofovir disoproxil fumarát a emtricitabin u antiretrovirálně naivních dospělých s infekcí HIV-1 (GEMINI-1 a GEMINI-2): výsledky 48. týdne ze dvou multicentrických, dvojitě zaslepených, randomizovaných, non-inferioritních studií fáze 3. Lancet. 2019;393(10167):143-155.
28. Mayer KH, Molina JM, Thompson MA, et al. Emtricitabine and tenofovir alafenamide vs. emtricitabine and tenofovir disoproxil fumarate for HIV pre-exposure prophylaxis (DISCOVER): primary results from a randomized, double-blind multicentre, active-controlled, phase 3 non-inferiority trial. Lancet. 2020;396(10246):239-254.
29. Hill A, Hughes SL, Gotham D, Pozniak AL. Tenofovir alafenamid versus tenofovir disoproxil fumarát: existuje skutečný rozdíl v účinnosti a bezpečnosti? J Virus Erad. 2018;4(2):72-79.