Das chemische Element Chlor zählt zu den Halogenen und ist ein Nichtmetall. Es wurde 1774 von Carl Wilhelm Scheele entdeckt.

Datenbereich
| Klassifizierung: | Chlor ist ein Halogen und ein Nichtmetall |
| Farbe: | grünlich-gelb |
| Atomgewicht: | 35.453 |
| Zustand: | Gas |
| Schmelzpunkt: | -101 oC , 172 K |
| Siedepunkt: | -34 oC , 239 K |
| Elektronen: | 17 |
| Protonen: | 17 |
| Neutronen in häufigstem Isotop: | 18 |
| Elektronenschalen: | 2,8,7 |
| Elektronenkonfiguration: | 1s2 2s2 2p6 3s2 3p5 |
| Dichte @ 20oC: | 0.003214 g/cm3 |
Mehr anzeigen, darunter: Wärme, Energie, Oxidation, Reaktionen,
Verbindungen, Radien, Leitfähigkeiten
| Atomvolumen: | 22,7 cm3/mol |
| Struktur: | Schichten von Cl2 im Festkörper |
| Härte: | |
| Spezifische Wärmekapazität | 0,48 J g-1 K-1 |
| Schmelzwärme | 6.406 kJ mol-1 von Cl2 |
| Zerstäubungswärme | 122 kJ mol-1 |
| Verdampfungswärme | 20.41 kJ mol-1 von Cl2 |
| 1. Ionisierungsenergie | 1251,1 kJ mol-1 |
| 2. Ionisierungsenergie | 2297.3 kJ mol-1 |
| 3. Ionisierungsenergie | 3821.8 kJ mol-1 |
| Elektronenaffinität | 349 kJ mol-1 |
| Mindestoxidationszahl | -1 |
| Min. gemeinsame Oxidationszahl | -1 |
| Maximale Oxidationszahl | 7 |
| Max. gemeinsame Oxidationszahl | 7 |
| Elektronegativität (Pauling-Skala) | 3,16 |
| Polarisierbarkeit Volumen | 2.2 Å3 |
| Reaktion mit Luft | keine |
| Reaktion mit 15 M HNO3 | mild, ⇒ HClOx, NOxCl, NOx |
| Reaktion mit 6 M HCl | mild, ⇒ HOCl, Cl- |
| Reaktion mit 6 M NaOH | mild, ⇒ OCl-, Cl- |
| Oxid(e) | Cl2O, ClO2, Cl2O7 |
| Hydrid(e) | HCl |
| Chlorid(e) | Cl2 |
| Atomradius | 100 pm |
| Ionischer Radius (1+ Ion) | – |
| Ionenradius (2+ Ion) | – |
| Ionenradius (3+ Ion) | – |
| Ionenradius (1- Ion) | 167 pm |
| Ionenradius (2- Ion) | – |
| Ionenradius (3- Ion) | – |
| Wärmeleitfähigkeit | 0.0089 W m-1 K-1 |
| Elektrische Leitfähigkeit | – |
| Gefrier-/ Schmelzpunkt: | -101 oC , 172 K |

Chlor im Reagenzglas (Foto: Ben Mills)
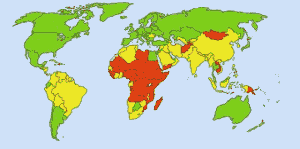
Sicheres Trinkwasser: Bild: Ionut_Cojocaru. In grünen Gebieten kann jeder sicheres Wasser bekommen. In roten Gebieten können mindestens 25 Prozent der Menschen kein aufbereitetes Wasser bekommen. Gelbe Gebiete liegen dazwischen. Vor der routinemäßigen Verwendung von Chlor in der Wasserversorgung der USA forderte Typhus jedes Jahr 25 000 Todesopfer. Heute werden 98 % der öffentlichen Wasserversorgung mit Chlor oder einer Chlorverbindung behandelt. Typhus fordert heute im Durchschnitt etwa ein Opfer pro Jahr. (4)

Carl Wilhelm Scheele, der 1774 Chlor entdeckte.
Entdeckung des Chlors
Chlor wurde erstmals 1774 von Carl Wilhelm Scheele in Schweden hergestellt. Scheele sammelte das Gas, das bei der Reaktion von Pyrolusit mit spiritus salis – ein alchemistischer Begriff, der Geist/Salzatem bedeutet – freigesetzt wurde. Das neue Gas hatte, so Scheele, „einen sehr wahrnehmbaren erstickenden Geruch, der auf die Lungen sehr drückend wirkte… und dem Wasser einen leicht sauren Geschmack gab… die Luft darin eine gelbe Farbe erhielt…“ (1)
Scheele bemerkte auch die hohe Reaktivität und die bleichenden Eigenschaften des neuen Gases, das er hergestellt hatte: „… alle Metalle wurden angegriffen… festes Alkali wurde in Kochsalz umgewandelt… alle pflanzlichen Blumen – rote, blaue und gelbe – wurden in kurzer Zeit weiß; dasselbe geschah auch mit grünen Pflanzen… Insekten starben sofort. (1)
Trotz der Genauigkeit seiner Beobachtungen hielt Scheele das neue Gas fälschlicherweise für eine dephlostigierte Form der muriatischen Säure.
Der berühmte französische Chemiker Antoine Lavoisier glaubte, dass das neue Gas oxymuriatische Säure genannt werden sollte, basierend auf dem noch unentdeckten Element Murium. (2)
* Die Verwirrung über die wahre Identität des Chlors wurde durch die Phlogiston-Theorie verursacht; Phlogiston war von den Chemikern während des größten Teils der 1700er Jahre akzeptiert worden – bis Lavoisier selbst es entlarvte. Phlogiston war eine „Substanz“, die dazu diente, das damals Unerklärliche zu erklären. Praktischerweise hatte es negatives Gewicht, wenn es gebraucht wurde, und „erklärte“ Reaktionen wie Rost und Verbrennung.
Lavoisier war der Architekt des Untergangs von Phlogiston, indem er zeigte, dass die Chemie des Sauerstoffs eine bessere Erklärung für chemische Reaktionen war als Phlogiston selbst. (3)
Um 1810 war man sich in der Wissenschaft einig, dass das Element, das wir heute Chlor nennen, in Wirklichkeit eine Verbindung ist, die Sauerstoff enthält. Der englische Chemiker Sir Humphry Davy fand heraus, dass dieser Konsens falsch war; er konnte das neue gelb-grüne Gas nicht dazu bringen, mit einer Kohleelektrode zu reagieren, was ihn zu der Überzeugung brachte, dass es möglicherweise keinen Sauerstoff enthielt. In Reaktionen mit Phosphor und Ammoniak wies er nach, dass das neue Gas keinen Sauerstoff enthielt. Er verwendete einen riesigen Plattenvoltaikhaufen mit 2000 Platten, um zu sehen, ob er Sauerstoff aus den Phosphor- und Schwefelverbindungen des Gases extrahieren konnte, aber auch hier fand er keinen Sauerstoff. (1a)
1811 kam Davy zu dem Schluss, dass es sich bei dem neuen Gas tatsächlich um ein neues Element handelte. (1b) Er nannte es Chlor, nach dem griechischen Wort „chloros“, das blassgrün oder gelb-grün bedeutet.
Interessante Fakten über Chlor
- Die erste entdeckte Kettenreaktion war keine Kernreaktion, sondern eine chemische Kettenreaktion. Sie wurde 1913 von Max Bodenstein entdeckt, der sah, wie ein Gemisch aus Chlor- und Wasserstoffgasen explodierte, wenn es durch Licht ausgelöst wurde. Der Mechanismus der Kettenreaktion wurde 1918 von Walther Nernst vollständig erklärt.
- Die Ozeane der Erde enthalten große Mengen an Chlor. Wenn dieses Chlor als Gas freigesetzt würde, wäre sein Gewicht 5x größer als die gesamte derzeitige Erdatmosphäre. (Unsere Ozeane enthalten etwa 2,6 x 1016 Tonnen Chlor, hauptsächlich in Form von Natriumchlorid.)
- Chlor ist nicht nur in unseren Ozeanen reichlich vorhanden; es ist das sechsthäufigste Element in der Erdkruste.
- Eine Exposition gegenüber kleinen Mengen Chlor, selbst für kurze Zeit, kann tödlich sein. Bei 1 Teil pro Tausend Chlor in der Luft (oder manchmal bei noch niedrigeren Konzentrationen) wird mit Todesfällen gerechnet. (5)
- Chlor ist schwerer als Luft. Wenn es freigesetzt wird, bildet es einen giftigen Schleier, der mit dem Wind verweht wird. Chlor wurde im Ersten Weltkrieg als chemische Waffe eingesetzt, zunächst 1915 von der deutschen Armee und dann von den westlichen Alliierten. Es war nicht so „wirksam“ wie erhofft, denn Chlor ist durch seinen starken Geruch leicht zu erkennen. Außerdem ist es wasserlöslich, so dass sich die Soldaten vor den schlimmsten Auswirkungen schützen konnten, indem sie durch feuchte Tücher atmeten.

Aussehen und Eigenschaften
Schädliche Auswirkungen:
Chlor ist ein giftiges Gas, das die Haut, die Augen und die Atemwege reizt.
Eigenschaften:
Chlor ist ein grünlich-gelbes, zweiatomiges, dichtes Gas mit einem scharfen Geruch (Geruch von Bleichmittel).
Es kommt in der Natur nicht frei vor, da es sich leicht mit fast allen anderen Elementen verbindet.
Chlor kommt in der Natur vor allem als Kochsalz (NaCl), Carnallit und Sylvit (KCl) vor.
In flüssiger und fester Form ist es ein starkes Bleich-, Oxidations- und Desinfektionsmittel.
Verwendungen von Chlor
Chlor wird zur Herstellung von sicherem Trinkwasser verwendet.
Chlorierte Verbindungen werden vor allem in der Hygiene, Zellstoffbleiche, als Desinfektionsmittel und in der Textilverarbeitung eingesetzt.
Chlor wird auch für die Herstellung von Chloraten verwendet und ist wichtig in der organischen Chemie, wo es Verbindungen wie Chloroform, Tetrachlorkohlenstoff, Polyvinylchlorid und synthetischen Kautschuk bildet.
Andere Verwendungszwecke von Chlorverbindungen sind Farbstoffe, Erdölprodukte, Arzneimittel, Antiseptika, Insektizide, Lebensmittel, Lösungsmittel, Farben und Kunststoffe.
Häufigkeit und Isotope
Häufigkeit Erdkruste: 145 Teile pro Million nach Gewicht, 85 Teile pro Million nach Mol
Häufigkeit Sonnensystem: 8 Teile pro Million nach Gewicht, 0,3 Teile pro Million nach Mol
Kosten, rein: 0,15 $ pro 100g
Kosten, lose: $ pro 100g
Quelle: Chlorgas wird kommerziell durch die Elektrolyse von Natriumchlorid (NaCl) aus Meerwasser oder Sole aus Salzbergwerken hergestellt.
Isotope: Chlor hat 16 Isotope, deren Halbwertszeiten bekannt sind, mit den Massenzahlen 31 bis 46. Natürlich vorkommendes Chlor ist ein Gemisch seiner beiden stabilen Isotope 35Cl und 37Cl mit natürlichen Häufigkeiten von 75,8 % bzw. 24,3 %.

- Henry M. Leicester, Herbert S. Klickstein, A Source Book in Chemistry, 1400-1900, (1969) Harvard University Press. p111; 1a. p241.; 1b. p257.
- J.W. Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry, 1922, Bd. 2, Longmans, Green and Co, S. 21.
- Antoine Lavoisier, Memoires de l‘ Academie royale des sciences 1783, 1786, S. 505-538.
- The Chlorine Tree.
- OSHA, Leitfaden für Sicherheit und Gesundheit am Arbeitsplatz für Chlor.
Diese Seite zitieren
Für die Online-Verknüpfung kopieren Sie bitte eine der folgenden Möglichkeiten:
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine</a>
oder
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine Element Facts</a>
Um diese Seite in einem akademischen Dokument zu zitieren, verwenden Sie bitte die folgende MLA-konforme Zitierweise:
"Chlorine." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/chlorine.html>.