Gallensalze und Gallensäuren sind polare Cholesterinderivate und stellen den Hauptweg für die Ausscheidung des Steroids aus dem Körper dar.
Es handelt sich um Moleküle mit ähnlicher, aber nicht identischer Struktur und unterschiedlichen physikalischen und biologischen Eigenschaften.
Sie werden in der Leber synthetisiert, in der Gallenblase gespeichert, in den Zwölffingerdarm ausgeschieden und schließlich größtenteils im Ileum resorbiert.
Da diese Moleküle bei physiologischem pH-Wert als Anionen vorliegen, werden die Begriffe Gallensäure und Gallensalze hier als Synonyme verwendet.
Bestandteile
- Chemische Struktur der Gallensalze
- Primäre, konjugierte und sekundäre Gallensalze
- Funktion der Gallensäuren
- Enterohepatischer Kreislauf der Gallensalze
- Intestinaler Stoffwechsel der Gallensäuren
- Lösliche Fasern und Rückresorption von Gallensalzen
- Synthese der primären Gallensäuren
- Der klassische oder neutrale Weg
- Der alternative oder saure Weg
- Nebenwege
- Gallensalze: Regulation der Synthese
- Chemische Struktur der Gallensalze
- Primäre, konjugierte und sekundäre Gallensalze
- Funktion der Gallensäuren
- Enterohepatische Zirkulation von Gallensalzen
- Intestinaler Metabolismus der Gallensäuren
- Lösliche Ballaststoffe und Rückresorption von Gallensalzen
- Synthese der primären Gallensäuren
- Der klassische oder neutrale Weg
- Der alternative oder saure Weg
- Nebenwege
- Gallensalze: Regulation der Synthese
Chemische Struktur der Gallensalze
Gallensalze haben Ähnlichkeiten und Unterschiede mit dem Cholesterinmolekül.
Wie die Steroide haben sie einen Kern, der sich aus vier verschmolzenen Ringen zusammensetzt: drei Cyclohexanringe, bezeichnet mit A, B und C, und ein Cyclopentanring, bezeichnet mit D. Diese Struktur ist das Perhydrocyclopentanophenanthren, besser bekannt als Steroidkern.
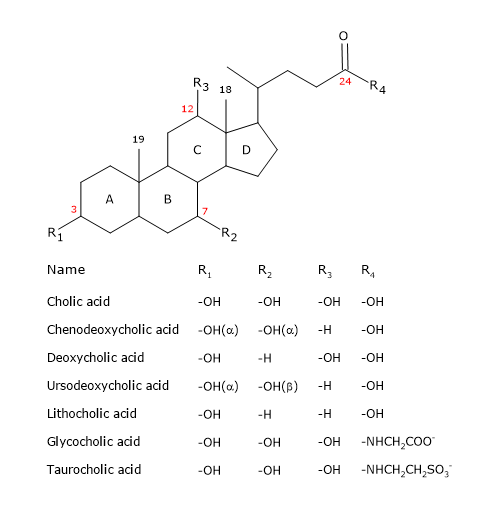
In höheren Wirbeltieren haben sie 24 Kohlenstoffatome, da die Seitenkette drei Kohlenstoffe kürzer ist als die ursprüngliche. Bei niederen Wirbeltieren haben die Gallensäuren 25, 26 oder 27 Kohlenstoffatome. Die Seitenkette endet mit einer Carboxylgruppe, die bei pH 7 ionisiert ist und mit der Aminosäure Glycin oder Taurin verbunden sein kann (siehe unten).
Zusätzlich zur Hydroxylgruppe an Position 3 haben sie Hydroxylgruppen an den Positionen 7 und/oder 12.
All dies macht sie viel polarer als Cholesterin.
Da die Ringe A und B in der cis-Konfiguration verschmolzen sind, ist die planare Struktur des Steroidkerns gekrümmt, und es ist möglich:
- eine konkave Seite zu identifizieren, die hydrophil ist, weil die Hydroxylgruppen und die Carboxylgruppe der Seitenkette, mit oder ohne die verknüpfte Aminosäure, zu ihr hin orientiert sind;
- eine konvexe Seite, die hydrophob ist, weil die Methylgruppen in Position 18 und 19 zu ihr hin orientiert sind.
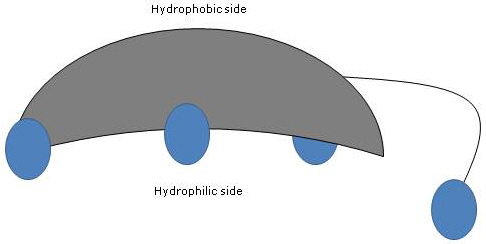
Da sie sowohl polare als auch unpolare Gruppen haben, sind sie amphiphile Moleküle und ausgezeichnete Tenside. Durch ihre chemische Struktur unterscheiden sie sich jedoch von vielen anderen Tensiden, die oft aus einem polaren Kopfbereich und einem unpolaren Schwanz bestehen.
Primäre, konjugierte und sekundäre Gallensalze
Primäre Gallensäuren sind solche, die in den Hepatozyten direkt aus Cholesterin synthetisiert werden. Beim Menschen sind die wichtigsten die Cholsäure und die Chenodeoxycholsäure, die 80 % aller Gallensäuren ausmachen. Bevor sie in die Gallenwege ausgeschieden werden, sind sie fast vollständig (bis zu 98 %) mit Glycin oder Taurin konjugiert, um Glykokonjugate bzw. Taurokonjugate zu bilden. Insbesondere werden etwa 75 % der Cholsäure und der Chenodeoxycholsäure mit Glycin konjugiert, um Glycocholsäure und Glycochenodeoxycholsäure zu bilden, die restlichen 25 % mit Taurin, um Taurocholsäure und Taurochenodeoxycholsäure zu bilden.
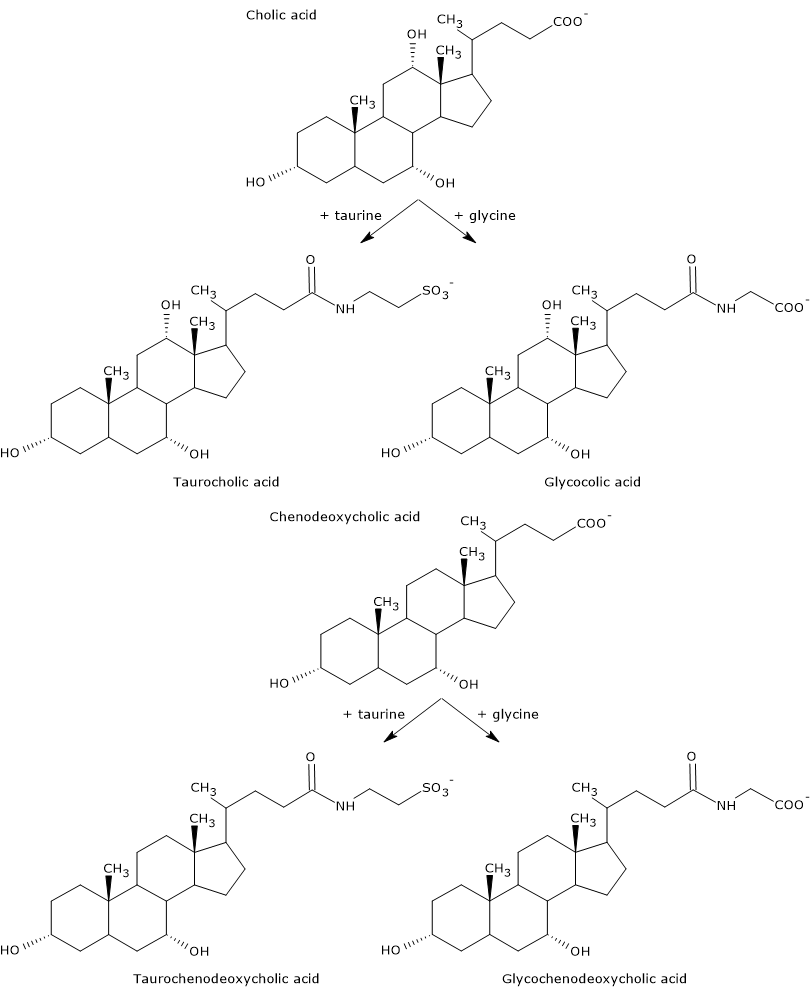
Konjugierte Gallensäuren sind Moleküle mit mehr hydrophilen Gruppen als unkonjugierte Gallensäuren, daher mit einer erhöhten Emulgierfähigkeit. Durch die Konjugation sinkt der pKa-Wert der Gallensäuren von etwa 6, einem typischen Wert für nicht konjugierte Moleküle, auf etwa 4 für Glycocholsäure und etwa 2 für Taurocholsäure. Dies bedeutet, dass konjugierte Gallensäuren in einem breiteren pH-Bereich ionisiert werden, um die entsprechenden Salze zu bilden.
Die Hydrophilie der gemeinsamen Säure und der Gallensalze nimmt in folgender Reihenfolge ab: Glycin-konjugiert < Taurin-konjugiert < Lithocholsäure < Desoxycholsäure < Chenodeoxycholsäure < Cholsäure < Cursodeoxycholsäure.
Schließlich verringert die Konjugation auch die Zytotoxizität der primären Gallensäuren.
Sekundäre Gallensäuren werden aus primären Gallensäuren gebildet, die nicht aus dem Dünndarm resorbiert wurden. Sobald sie den Dickdarm erreichen, können sie durch die Darmmikrobiota mehrere Modifikationen erfahren, um sekundäre Gallensäuren zu bilden (siehe unten). Sie machen die verbleibenden 20 % des körpereigenen Gallensäurepools aus.
Eine andere Möglichkeit, Gallensalze zu kategorisieren, basiert auf ihrer Konjugation mit Glycin und Taurin und ihrem Hydroxylierungsgrad. Auf dieser Grundlage werden drei Kategorien unterschieden.
- Trihydroxykonjugate, wie Taurocholsäure und Glycocholsäure.
- Dihydroxykonjugate, wie Glycodeoxycholsäure, Glycochenodeoxycholsäure, Taurochenodeoxycholsäure und Taurodeoxycholsäure. Sie machen etwa 60 % der in der Galle vorhandenen Gallensalze aus.
- Unkonjugierte Formen, wie Cholsäure, Desoxycholsäure, Chenodesoxycholsäure und Lithocholsäure.
Funktion der Gallensäuren
Alle ihre physiologischen Funktionen werden in der konjugierten Form ausgeführt.
- Sie sind der Hauptweg für die Ausscheidung von Cholesterin aus dem menschlichen Körper.
Der Mensch verfügt nämlich weder über die Enzyme, um die Cyclohexanringe oder den Cyclopentanring des Steroidkerns aufzuspalten, noch um Cholesterin zu CO2 und Wasser zu oxidieren.
Der andere Mechanismus zur Ausscheidung des Steroids aus dem Körper ist das Cholesterin selbst in der Galle. - Gallensalze sind starke Tenside. Insbesondere die konjugierten Di- und Trihydroxysalze sind die besten Tenside unter den Gallensäuren und viel wirksamer als die unkonjugierten Gegenstücke, da sie mehr polare Gruppen aufweisen.
Bei Kontakt mit apolaren Lipiden im Lumen des Dünndarms interagiert die konvexe apolare Oberfläche mit den apolaren Lipiden, wie Triglyceriden, Cholesterinestern und Estern fettlöslicher Vitamine, während die konkave polare Oberfläche mit dem umgebenden wässrigen Medium interagiert. Dies erhöht die Dispersion apolarer Lipide im wässrigen Medium, da es die Bildung winziger Lipidtröpfchen ermöglicht, was die Oberfläche vergrößert für:
Lipaseaktivität, hauptsächlich Pankreaslipase (Gallensalze spielen auch eine direkte Rolle bei der Aktivierung dieses Enzyms);
intestinale Esteraseaktivität.
So erleichtern sie die Aufnahme von Produkten der Fettverdauung sowie von fettlöslichen Vitaminen durch die Darmschleimhaut dank der Bildung von Mischmizellen.
Eine ähnliche Funktion erfüllen die Gallensäuren in der Gallenblase, wo sie durch die Bildung von Mischmizellen mit Phospholipiden die Ausfällung von Cholesterin verhindern.
Anmerkung: Infolge der Anordnung von polaren und unpolaren Gruppen bilden Gallensäuren in wässriger Lösung Mizellen, die in der Regel aus weniger als 10 Monomeren bestehen, solange ihre Konzentration über der sogenannten kritischen Mizellenkonzentration (CMC) liegt.
- Auf intestinaler Ebene modulieren sie die Sekretion von Pankreasenzymen und Cholecystokinin.
- Im Dünn- und Dickdarm haben sie eine starke antimikrobielle Aktivität, vor allem die Desoxycholsäure, insbesondere gegen grampositive Bakterien. Diese Aktivität kann auf eine oxidative DNA-Schädigung und/oder auf die Schädigung der Zellmembran zurückzuführen sein. Daher spielen sie eine wichtige Rolle bei der Verhinderung einer bakteriellen Überwucherung, aber auch bei der Regulierung der Zusammensetzung der Darmmikrobiota.
- In den letzten Jahren wird ihre regulierende Rolle bei der Kontrolle des Energiestoffwechsels und insbesondere bei der hepatischen Glukoseverarbeitung deutlich.
Enterohepatische Zirkulation von Gallensalzen
Nach der Fettaufnahme sezernieren enteroendokrine Zellen des Duodenums Cholecystokinin in den Blutkreislauf. Das Hormon bindet an Rezeptoren auf glatten Muskelzellen der Gallenblase und fördert deren Kontraktion; außerdem bewirkt das Hormon die Entspannung des Schließmuskels von Oddi. All dies führt zur Sekretion von Galle und damit von Gallensäuren in den Zwölffingerdarm.
Unter physiologischen Bedingungen ist der menschliche Gallensalzpool konstant und entspricht etwa 3-5 g. Dies wird durch zwei Prozesse ermöglicht:
- ihre intestinale Reabsorption;
- ihre De-novo-Synthese (siehe unten).
Bis zu 95 % der ausgeschiedenen Gallensalze werden aus dem Darm resorbiert, und zwar nicht zusammen mit den Produkten der Fettverdauung, sondern durch einen Prozess, der enterohepatischer Kreislauf genannt wird.
Es handelt sich um ein äußerst effizientes Recyclingsystem, das bei jeder Mahlzeit mindestens zweimal auftritt und die Leber, den Gallenbaum, den Dünndarm, den Dickdarm und den portalen Kreislauf umfasst, durch den die resorbierten Moleküle zur Leber zurückkehren. Diese Rezirkulation ist notwendig, da die Kapazität der Leber zur Synthese von Gallensäuren begrenzt ist und nicht ausreicht, um den Bedarf des Darms zu decken, wenn die Gallensalze in großen Mengen mit den Fäkalien ausgeschieden würden.
Die meisten Gallensalze werden im distalen Ileum, dem unteren Teil des Dünndarms, durch einen natriumabhängigen Transporter innerhalb des Bürstensaums der Enterozyten resorbiert, der als natriumabhängiger Gallensäuretransporter oder ASBT bezeichnet wird und den Cotransport eines Moleküls Gallensäure und zweier Natriumionen durchführt.
Innerhalb des Enterozyten werden die Gallensäuren vermutlich durch das ileale Gallensäure-bindende Protein (IBABP) durch das Zytosol zur basolateralen Membran transportiert. Sie überqueren die basolaterale Membran durch den organischen Lösungsmittel-Transporter alpha-beta oder OSTα/OSTβ, gelangen in den portalen Kreislauf und erreichen, an Albumin gebunden, die Leber.
Es ist zu beachten, dass ein kleiner Prozentsatz der Gallensäuren die Leber durch die Leberarterie erreicht.
Auf hepatischer Ebene ist ihre Extraktion sehr effizient, mit einer First-Pass-Extraktionsfraktion von 50 bis 90 %, ein Prozentsatz, der von der Struktur der Gallensäuren abhängt. Die Aufnahme konjugierter Gallensäuren wird hauptsächlich durch ein Na+-abhängiges aktives Transportsystem vermittelt, d.h. durch das Natrium-abhängige Taurocholat-cotransportierende Polypeptid (NTCP). Es kann jedoch auch zu einer natriumunabhängigen Aufnahme kommen, die durch Proteine aus der Familie der organischen anionentransportierenden Polypeptide (OATP), hauptsächlich OATP1B1 und OATP1B3, erfolgt.
Der geschwindigkeitsbeschränkende Schritt im enterohepatischen Kreislauf ist ihre kanalikuläre Sekretion, die hauptsächlich durch die Gallensalzexportpumpe (BSEP) in einem ATP-abhängigen Prozess vermittelt wird. Diese Pumpe transportiert monoanionische Gallensalze, die am häufigsten vorkommen. Mit Glucuronsäure oder Sulfat konjugierte Gallensäuren, die dianionisch sind, werden von anderen Carriern wie MRP2 und BCRP transportiert.
Anmerkung: Die Serumspiegel von Gallensäuren variieren in Abhängigkeit von ihrer Resorptionsrate und sind daher während der Mahlzeiten höher, wenn der enterohepatische Kreislauf aktiver ist.
Intestinaler Metabolismus der Gallensäuren
Gallensäuren, die der ilealen Absorption entgehen, gelangen in den Dickdarm, wo sie teilweise durch die Darmmikrobiota modifiziert und in sekundäre Gallensäuren umgewandelt werden.
Die wichtigsten Reaktionen sind im Folgenden aufgeführt.
- Dekonjugation
An der Seitenkette kann es zu einer Hydrolyse der C24-N-Acylamid-Bindung kommen, wobei unkonjugierte Gallensäuren und Glycin oder Taurin freigesetzt werden. Diese Reaktion wird durch bakterielle Hydrolasen katalysiert, die sowohl im Dünn- als auch im Dickdarm vorkommen. - 7α-Dehydroxylierung
Quantitativ gesehen ist dies die wichtigste Reaktion, die von bakteriellen Dehydratasen im Dickdarm durchgeführt wird, die die Hydroxylgruppe an Position 7 entfernen, um 7-Desoxygallensäuren zu bilden. Insbesondere wird aus Cholsäure Desoxycholsäure und aus Chenodeoxycholsäure Lithocholsäure, eine toxische sekundäre Gallensäure, gebildet.
Es ist zu beachten, dass die 7α-Dehydroxylierung im Gegensatz zur Oxidation und Epimerisierung (siehe unten) nur an unkonjugierten Gallensäuren stattfinden kann und daher die Dekonjugation eine wesentliche Voraussetzung ist. - Oxidation und Epimerisierung
Es handelt sich um Reaktionen, an denen die Hydroxylgruppen an den Positionen 3, 7 und 12 beteiligt sind und die von bakteriellen Hydroxysteroid-Dehydrogenasen katalysiert werden. Zum Beispiel entsteht Ursodeoxycholsäure durch Epimerisierung von Chenodeoxycholsäure.
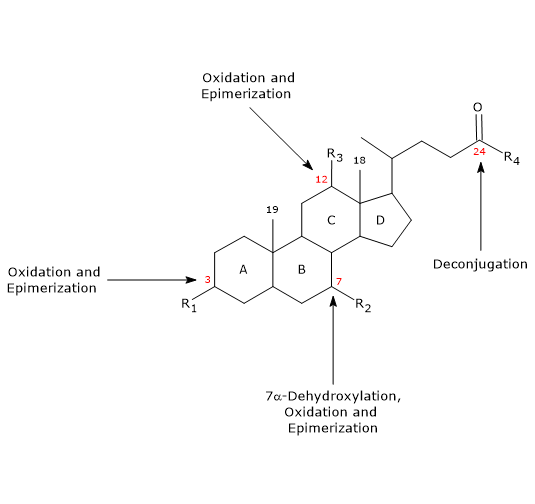
Ein Teil der sekundären Gallensäuren wird dann aus dem Dickdarm resorbiert und kehrt in die Leber zurück. In den Hepatozyten werden sie, wenn nötig, rekonjugiert und wieder ausgeschieden. Diejenigen, die nicht resorbiert werden, werden mit den Fäkalien ausgeschieden.
Während Oxidationen und Dekonjugationen von einem breiten Spektrum anaerober Bakterien durchgeführt werden, wird die 7α-Dehydroxylierung von einer begrenzten Anzahl von Kolon-Anaerobiern durchgeführt.
7α-Dehydroxylierungen und Dekonjugationen erhöhen den pKa-Wert der Gallensäuren und damit ihre Hydrophobizität, was ein gewisses Maß an passiver Absorption durch die Dickdarmwand ermöglicht.
Die Erhöhung der Hydrophobizität ist auch mit einer erhöhten Toxizität dieser Moleküle verbunden. Eine hohe Konzentration sekundärer Gallensäuren in der Galle, im Blut und in den Fäkalien wird mit der Entstehung von Dickdarmkrebs in Verbindung gebracht.
Lösliche Ballaststoffe und Rückresorption von Gallensalzen
Die Rückresorption von Gallensalzen kann durch die chelatbildende Wirkung löslicher Ballaststoffe, wie sie in frischem Obst, Hülsenfrüchten, Hafer und Haferkleie vorkommen, verringert werden, die die Gallensalze binden und ihre Aufnahme vermindern. Dies wiederum erhöht die De-novo-Synthese von Gallensäuren, indem die Expression der 7α-Hydroxylase und der Sterol-12α-Hydroxylase (siehe unten) hochreguliert wird, wodurch die Cholesterinkonzentration in den Hepatozyten verringert wird.
Die Verarmung des hepatischen Cholesterins erhöht die Expression des LDL-Rezeptors und verringert somit die Plasmakonzentration von LDL-Cholesterin. Andererseits stimuliert es auch die Synthese von HMG-CoA-Reduktase, dem Schlüsselenzym der Cholesterinbiosynthese.
Hinweis: Einige Anticholesterinmittel wirken, indem sie Gallensäuren im Darm binden und so deren Rückresorption verhindern.
Synthese der primären Gallensäuren
Quantitativ gesehen sind Gallensäuren das Hauptprodukt des Cholesterinstoffwechsels.
Wie bereits erwähnt, halten der enterohepatische Kreislauf und ihre De-novo-Synthese die Größe des Gallensäurepools konstant. Insbesondere ermöglicht die De-novo-Synthese den Ersatz der in den Gesichtern ausgeschiedenen Gallensalze, etwa 5-10% des Körperpools, d.h. ~ 0,5 g/Tag.
Im Folgenden wird die Synthese von Cholsäure und Chenodeoxycholsäure und ihre Konjugation mit den Aminosäuren Taurin und Glycin beschrieben.
Es gibt zwei Hauptwege für die Gallensäuresynthese: den klassischen Weg und den alternativen Weg. Darüber hinaus werden auch einige andere, weniger wichtige Wege beschrieben.
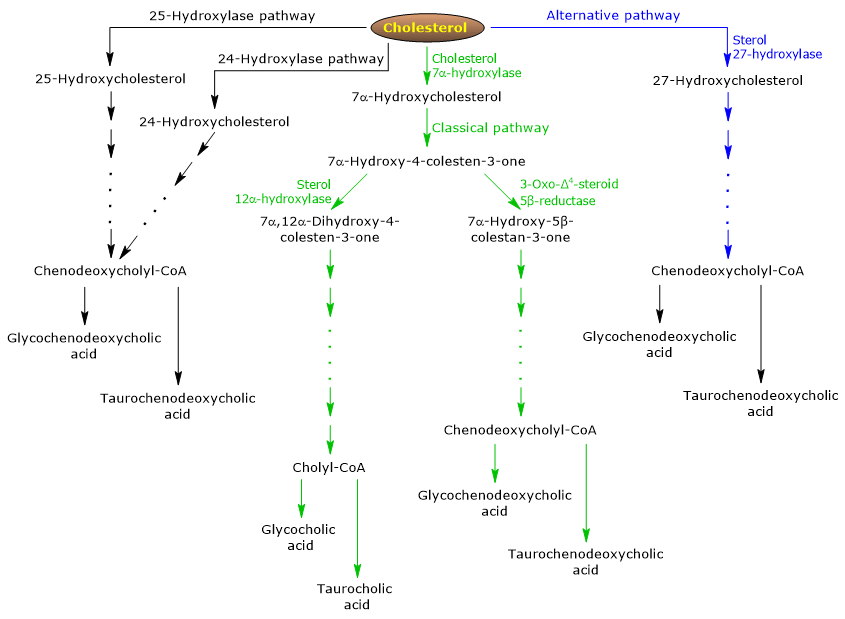
Der klassische oder neutrale Weg
Beim Menschen werden bis zu 90% der Gallensalze über den klassischen Weg (siehe Abb. 5) produziert, der auch als „neutraler“ Weg bezeichnet wird, da die Zwischenprodukte neutrale Moleküle sind.
Es handelt sich um einen Stoffwechselweg, der nur in der Leber vorkommt und aus Reaktionen besteht, die von Enzymen katalysiert werden, die im Zytosol, im endoplasmatischen Retikulum, in den Peroxisomen und in den Mitochondrien lokalisiert sind, und deren Endprodukte die Konjugate von Cholsäure und Chenodesoxycholsäure sind.
- Die erste Reaktion ist die Hydroxylierung von Cholesterin an Position 7, um 7α-Hydroxycholesterin zu bilden. Diese Reaktion wird von der Cholesterin-7α-Hydroxylase oder CYP7A1 (E.C. 1.14.14.23) katalysiert. Es handelt sich um ein Enzym, das im endoplasmatischen Retikulum lokalisiert ist und den ratenlimitierenden Schritt des Weges katalysiert.
Cholesterin + NADPH + H+ + O2 → 7α-Hydroxycholesterin + NADP+ + H2O
- 7α-Hydroxycholesterin unterliegt der Oxidation der 3β-Hydroxylgruppe und der Verschiebung der Doppelbindung von der 5,6-Position zur 4,5-Position, um 7α-Hydroxy-4-cholesten-3-on zu bilden. Die Reaktion wird von der 3β-Hydroxy-Δ5-C27-Steroid-Oxidoreduktase oder HSD3B7 (E.C. 1.1.1.181), einem im endoplasmatischen Retikulum lokalisierten Enzym, katalysiert.
- 7α-Hydroxy-4-cholesten-3-on kann zwei Wege einschlagen:
um in den Weg einzutreten, der zur Synthese von Cholsäure führt, und zwar durch die Reaktion, die von 7α-Hydroxy-4-cholesten-3-on 12α-Monooxygenase oder Sterol 12α-Hydroxylase oder CYP8B1 (E.C. 1.14.18.8), ein Enzym, das im endoplasmatischen Retikulum lokalisiert ist;
um in den Weg einzutreten, der zur Synthese von Chenodeoxycholsäure führt, und zwar durch die Reaktion, die von der 3-Oxo-Δ4-Steroid-5β-Reduktase oder AKR1D1 (E.C. 1.3.1.3), einem zytosolischen Enzym, katalysiert wird.
Es sollte betont werden, dass die Aktivität der Sterol 12α-Hydroxylase das Verhältnis von Cholsäure zu Chenodeoxycholsäure und letztlich die Detergenzkapazität des Gallensäurepools bestimmt. Und in der Tat ist die Regulierung der Sterol-12α-Hydroxylase-Gentranskription einer der wichtigsten regulatorischen Schritte des klassischen Stoffwechselwegs.
Wenn also 7α-Hydroxy-4-cholesten-3-on über die von der Sterol-12α-Hydroxylase katalysierte Reaktion abläuft, kommt es zu den folgenden Reaktionen.
- 7α-Hydroxy-4-cholesten-3-on wird an Position 12 durch Sterol 12α-Hydroxylase hydroxyliert, um 7α,12α-Dihydroxy-4-cholesten-3-on zu bilden.
- 7α,12α-Dihydroxy-4-cholesten-3-on wird in der durch die 3-Oxo-Δ4-Steroid-5β-Reduktase katalysierten Reaktion an der Doppelbindung in 4,5-Position reduziert, um 5β-Cholestan-7α,12α-diol-3-on zu bilden.
- 5β-Cholestan-7α,12α-diol-3-on unterliegt der Reduktion der Hydroxylgruppe an Position 4 in der Reaktion, die durch 3α-Hydroxysteroiddehydrogenase oder AKR1C4 (EC 1.1.1.213), einem zytosolischen Enzym, katalysiert wird, um 5β-Cholestan-3α,7α,12α-triol zu bilden.
- 5β-Cholestan-3α,7α,12α-triol unterliegt der Oxidation der Seitenkette über drei Reaktionen, die von der Sterol 27-Hydroxylase oder CYP27A1 (EC 1.14.15.15) katalysiert werden. Es handelt sich um ein mitochondriales Enzym, das auch in extrahepatischen Geweben und Makrophagen vorkommt und eine Hydroxylgruppe an Position 27 einführt. Die Hydroxylgruppe wird zu Aldehyd und dann zu Carbonsäure oxidiert, um 3α,7α,12α-Trihydroxy-5β-cholestansäure zu bilden.
- 3α,7α,12α-Trihydroxy-5β-Cholestansäure wird zu ihrem Coenzym-A-Ester, 3α,7α,12α-Trihydroxy-5β-Cholestanoyl-CoA, in der Reaktion aktiviert, die entweder durch sehr langkettige Acyl-CoA-Synthetase oder VLCS (EC 6.2.1.-) oder der Gallensäure-CoA-Synthetase oder BACS (EC 6.2.1.7) katalysiert wird, die beide im endoplasmatischen Retikulum lokalisiert sind.
- 3α,7α,12α-Trihydroxy-5β-cholestanoyl-CoA wird zu den Peroxisomen transportiert, wo es fünf aufeinanderfolgende Reaktionen durchläuft, die jeweils von einem anderen Enzym katalysiert werden. In den letzten beiden Reaktionen wird die Seitenkette auf vier Kohlenstoffatome verkürzt, und schließlich wird Cholyl-CoA gebildet.
- Im letzten Schritt erfolgt die Konjugation der Carbonsäuregruppe der Seitenkette mit der Aminosäure Glycin oder Taurin über eine Amidbindung. Die Reaktion wird durch die Gallensäure-CoA:Aminosäure-N-Acyltransferase oder BAAT (EC 2.3.1.65) katalysiert, die überwiegend in Peroxisomen lokalisiert ist.
Die Reaktionsprodukte sind somit die konjugierten Gallensäuren: Glycocholsäure und Taurocholsäure.
Wenn 7α-Hydroxy-4-cholesten-3-on nicht über die von der Sterol-12α-Hydroxylase katalysierte Reaktion abläuft, gelangt es über die nachfolgend beschriebenen Reaktionen in den Weg, der zur Synthese der konjugierten Chenodeoxycholsäure führt.
- 7α-Hydroxy-4-cholesten-3-on wird in der durch 3-Oxo-Δ4-Steroid-5β-Reduktase katalysierten Reaktion in 7α-Hydroxy-5β-cholestan-3-on umgewandelt.
- 7α-Hydroxy-5β-cholestan-3-on wird in der durch 3α-Hydroxysteroid-Dehydrogenase katalysierten Reaktion in 5β-Cholestan-3α,7α-diol umgewandelt.
Danach werden die konjugierten Gallensäuren Glycochenodeoxycholsäure und Taurochenodeoxycholsäure durch ähnliche Modifikationen wie bei der Konjugation von Cholsäure gebildet und größtenteils durch die gleichen Enzyme katalysiert.
Anmerkung: Unkonjugierte Gallensäuren, die im Darm gebildet werden, müssen in die Leber gelangen, um dort rekonjugiert zu werden.
Der alternative oder saure Weg
ist beim Fötus und Neugeborenen vorherrschend, während er bei Erwachsenen zur Synthese von weniger als 10% der Gallensalze führt.
Dieser Weg (siehe Abb. 5) unterscheidet sich vom klassischen Weg. 5) unterscheidet sich vom klassischen Weg dadurch, dass:
- die Zwischenprodukte saure Moleküle sind, daher der alternative Name „saurer Weg“;
- auf die Oxidation der Seitenkette folgen Modifikationen des Steroidkerns und nicht umgekehrt;
- die Endprodukte sind Konjugate der Chenodeoxycholsäure.
Der erste Schritt ist die Umwandlung von Cholesterin in 27-Hydroxycholesterin in einer Reaktion, die von der Sterol 27-Hydroxylase katalysiert wird.
27-Hydroxycholesterin kann auf zwei Wegen entstehen.
Weg A
- 27-Hydroxycholesterin wird in einer durch Sterol 27-Hydroxylase katalysierten Reaktion in 3β-Hydroxy-5-cholestenoic acid umgewandelt.
- 3β-Hydroxy-5-cholestenoische Säure wird an Position 7 in einer Reaktion hydroxyliert, die von der Oxysterol 7α-Hydroxylase oder CYP7B1 (EC 1.14.13.100), einem im endoplasmatischen Retikulum lokalisierten Enzym, katalysiert wird, um 3β-7α-Dihydroxy-5-colestenoische Säure zu bilden.
- 3β-7α-Dihydroxy-5-cholestenoic acid wird in der von der 3β-Hydroxy-Δ5-C27-steroid oxidoreductase katalysierten Reaktion in 3-Oxo-7α-hydroxy-4-cholestenoic acid umgewandelt.
- 3-Oxo-7α-hydroxy-4-cholestenoic acid bildet als Ergebnis der Seitenkettenmodifikationen Chenodeoxycholic acid und dann deren Konjugate.
Weg B
- 27-Hydroxycholesterin wird in der durch Oxysterol-7α-Hydroxylase und Cholesterol-7α-Hydroxylase katalysierten Reaktion in 7α,27-Dihydroxycholesterin umgewandelt.
- 7α,27-Dihydroxycholesterin wird in der durch 3β-Hydroxy-Δ5-C27-Steroidoxidoreduktase katalysierten Reaktion in 7α,26-Dihydroxy-4-cholesten-3-on umgewandelt;
7α, 26-Dihydroxy-4-cholesten-3-on kann direkt in Konjugate von Chenodeoxycholsäure umgewandelt werden oder kann in 3-Oxo-7α-hydroxy-4-colestenoic acid umgewandelt werden und dann Seitenkettenmodifikationen und anderen Reaktionen unterliegen, die zur Synthese der Konjugate von Chenodeoxycholsäure führen.
Nebenwege
Es gibt auch Nebenwege (siehe Abb. 5), die zur Gallensalzsynthese beitragen, wenn auch in geringerem Maße als die klassischen und alternativen Wege.
Zum Beispiel:
- Eine Cholesterin-25-Hydroxylase (EC 1.14.99.38) wird in der Leber exprimiert.
- Eine Cholesterin-24-Hydroxylase oder CYP46A1 (EC 1.14.14.25) wird im Gehirn exprimiert, so dass dieses Organ zwar kein Cholesterin, aber Oxysterole exportieren kann.
- Eine unspezifische 7α-Hydroxylase ist ebenfalls entdeckt worden. Sie wird in allen Geweben exprimiert und scheint an der Bildung von Oxysterolen beteiligt zu sein, die zu den Hepatozyten transportiert werden können, um dort in Chenodesoxycholsäure umgewandelt zu werden.
Außerdem wird die Sterol-27-Hydroxylase in verschiedenen Geweben exprimiert, weshalb ihre Reaktionsprodukte zur Leber transportiert werden müssen, um in Gallensalze umgewandelt zu werden.
Gallensalze: Regulation der Synthese
Die Regulation der Gallensäuresynthese erfolgt über einen negativen Rückkopplungsmechanismus, insbesondere auf die Expression von Cholesterin-7α-Hydroxylase und Sterol-12α-Hydroxylase.
Bei einem Überschuss an freien und konjugierten Gallensäuren binden diese Moleküle an den Kernrezeptor Farnesoid-X-Rezeptor (FRX) und aktivieren ihn: Die wirksamste Gallensäure ist Chenodesoxycholsäure, während andere, wie Ursodesoxycholsäure, ihn nicht aktivieren.
FRX induziert die Expression des Transkriptionsrepressors Small Heterodimer Partner (SHP), der wiederum mit anderen Transkriptionsfaktoren wie dem Leberrezeptor-Homolog-1 (LRH-1) und dem Hepatozyten-Kernfaktor-4α (HNF-4α) interagiert. Diese Transkriptionsfaktoren binden an eine Sequenz in der Promotorregion der 7α-Hydroxylase- und 12α-Hydroxylase-Gene, die als Gallensäure-Response-Elemente oder BAREs bezeichnet werden, und hemmen deren Transkription.
Einer der Gründe, warum die Gallensalzsynthese streng reguliert ist, ist, dass viele ihrer Metaboliten toxisch sind.
Chiang J.Y.L. Bile acids: regulation of synthesis. J Lipid Res 2009;50(10):1955-66. doi:10.1194/jlr.R900010-JLR200
Gropper S.S., Smith J.L. Advanced nutrition and human metabolism. 6h Edition. Cengage Learning, 2012
Moghimipour E., Ameri A., and Handali S. Absorption-enhancing effects of bile salts. Molecules 2015;20(8); 14451-73. doi:10.3390/molecules200814451
Monte M.J., Marin J.J.G., Antelo A., Vazquez-Tato J. Bile acids: Chemistry, physiology, and pathophysiology. World J Gastroenterol 2009;15(7):804-16. doi:10.3748/wjg.15.804
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal M.D., Glew R.H. Medical biochemistry – Human metabolism in health and disease. John Wiley J. & Sons, Inc, Publication, 2009
Sundaram S.S., Bove K.E., Lovell M.A. and Sokol R.J. Mechanisms of Disease: inborn errors of bile acid synthesis. Nat Clin Pract Gastroenterol Hepatol 2008;5(8):456-68. doi:10.1038/ncpgasthep1179