Oppimistavoitteet
- Tunnista alkaanit, alkeenit, alkyynit ja aromaattiset yhdisteet.
- Luettele joitakin hiilivetyjen ominaisuuksia.
Yksinkertaisimmat orgaaniset yhdisteet koostuvat vain kahdesta alkuaineesta: hiilestä ja vedystä. Näitä yhdisteitä kutsutaan hiilivedyiksi. Itse hiilivedyt jaetaan kahteen tyyppiin: alifaattisiin hiilivetyihin ja aromaattisiin hiilivetyihin. Alifaattiset hiilivedyt ovat hiilivetyjä, jotka perustuvat C-atomien ketjuihin. Alifaattisia hiilivetyjä on kolmenlaisia. Alkaanit ovat alifaattisia hiilivetyjä, joissa on vain yksittäisiä kovalenttisia sidoksia. Alkeenit ovat alifaattisia hiilivetyjä, jotka sisältävät vähintään yhden C-C-kaksoissidoksen, ja alkyynit ovat alifaattisia hiilivetyjä, jotka sisältävät C-C-kolmisidoksen. Toisinaan tavataan alifaattisia hiilivetyjä, joissa on C-atomien rengas; näitä hiilivetyjä kutsutaan sykloalkaaneiksi (tai sykloalkeeneiksi tai sykloalkyyneiksi).
Aromaattiset hiilivedyt, kuten bentseeni,ovat litteitä rengassysteemejä, joissa on jatkuvasti päällekkäisiä p-orbitaaleja.Bentseenirenkaassa olevilla elektroneilla on erityisiä energeettisiä ominaisuuksia, jotka antavat bentseenille fysikaalisia ja kemiallisia ominaisuuksia, jotka poikkeavat huomattavasti alkaaneista. Alun perin tästä yhdisteryhmästä käytettiin termiä aromaattinen, koska ne olivat erityisen tuoksuvia. Nykyaikaisessa kemiassa termi aromaattinen tarkoittaa kuitenkin hyvin stabiilin renkaan läsnäoloa, joka antaa molekyylille erilaisia ja ainutlaatuisia ominaisuuksia.
Yksinkertaisimmissa alkaaneissa C-atomit ovat sitoutuneet suoraksi ketjuksi; näitä kutsutaan tavallisiksi alkaaneiksi. Ne on nimetty ketjussa olevien C-atomien lukumäärän mukaan. Pienin alkaani on metaani:
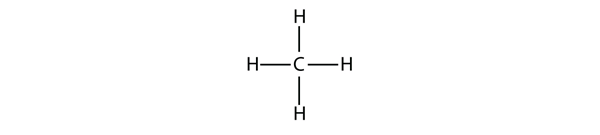
Kuva 16.1 Metaanin kolmiulotteinen esitys

Tehdäkseen neljä kovalenttista sidosta C-atomi sitoutuu neljään H-atomiin, jolloin metaanin molekyylikaava on CH4. Metaanin kaksiulotteinen kaavio on kuitenkin harhaanjohtava; neljä kovalenttista sidosta, jotka C-atomi muodostaa, ovat suuntautuneet kolmiulotteisesti tetraedrin kulmiin. Parempi esitys metaanimolekyylistä on esitetty kuvassa 16.1 ”Metaanin kolmiulotteinen esitys.”
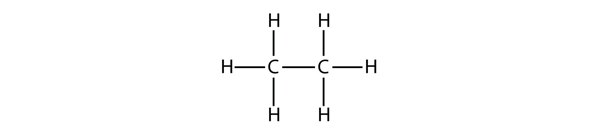
Seuraavaksi suurimmalla alkaanilla on kaksi C-atomia, jotka ovat kovalenttisesti sidoksissa toisiinsa. Jotta kukin C-atomi voisi muodostaa neljä kovalenttista sidosta, jokaisen C-atomin on oltava sidoksissa kolmeen H-atomiin. Näin syntyvä molekyyli, jonka kaava on C2H6, on etaani:
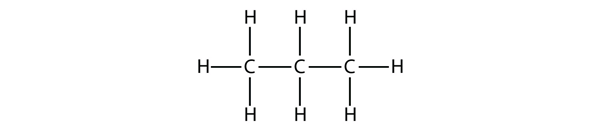
Propanin selkärangassa on kolme C-atomia, joita ympäröivät H-atomit. Sinun pitäisi pystyä tarkistamaan, että propaanin molekyylikaava on C3H8:
Tähän mennessä näkemämme alkaaneja esittävät kaaviot ovat melko yksinkertaisia Lewisin rakenteita. Molekyylien kasvaessa suuremmiksi Lewisin rakenteet muuttuvat kuitenkin yhä monimutkaisemmiksi. Yksi tapa kiertää tämä on käyttää tiivistettyä rakennetta,jossa luetellaan jokaisen C-atomin kaava molekyylin selkärangassa. Esimerkiksi etaanin tiivistetty rakenne on CH3CH3, kun taas propaanin rakenne on CH3CH2CH3. Taulukossa 16.1 ”Kymmenen ensimmäistä alkaania” on esitetty 10 ensimmäisen alkaanin molekyylikaavat, kondensoivat rakennekaavat ja nimet.
Taulukko 16.1 The First 10 Alkanes
| Molekyylikaava | Kondensoitu rakennekaava | Nimi |
|---|---|---|
| CH4 | CH4 | metaani |
| C2H6 | CH3CH3 | etaani |
| C3H8 | CH3CH2CH3 | propaani |
| C4H10 | CH3CH2CH2CH3 | butaani |
| C5H12 | CH3CH2CH2CH2CH3 | pentaani |
| C6H14 | CH3(CH2)4CH3 | heksaani |
| C7H16 | CH3(CH2)5CH3 | heptaani |
| C8H18 | CH3(CH2)6CH3 | oktaani |
| C9H20 | CH3(CH2)7CH3 | noktaani |
| C10H22 | CH3(CH2)8CH3 | dekaani |
Koska alkaaneilla on kovalenttisten sidosten sääntöjen mukaan suurin mahdollinen määrä H-atomeita, alkaaneja kutsutaan myös tyydyttyneiksi hiilivedyiksi.
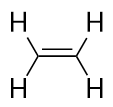
Alkeneissa on C-C-kaksoissidos. Koska niissä on vähemmän kuin suurin mahdollinen määrä H-atomeja, niitä kutsutaan tyydyttymättömiksi hiilivedyiksi. Pienimmällä alkeenilla – eteenillä – on kaksi C-atomia, ja se tunnetaan myös yleisnimellä etyleeni:
Seuraavaksi suurimmalla alkeenilla – propeenilla – on kolme C-atomia, ja kahden C-atomin välillä on C-C-kaksoissidos. Se tunnetaan myös nimellä propeeni:
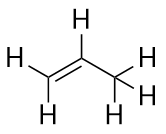
Mitä huomaat alkaanien ja alkeenien nimistä? Alkeenien nimet ovat samat kuin niitä vastaavien alkaanien nimet, paitsi että suffiksi (pääte) on -eeni eikä -aani. Kantaketjuksi kutsutun kantakielen käyttäminen osoittamaan C-atomien määrää molekyylissä ja päätteen käyttäminen orgaanisen yhdisteen tyyppiä on yleistä orgaanisessa kemiassa, kuten tulemme näkemään.
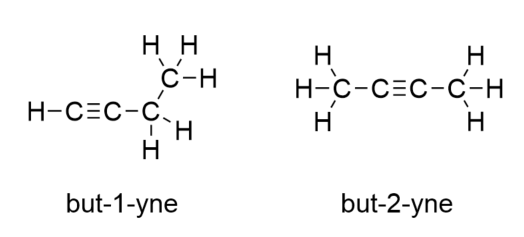
Seuraavan alkeenin, buteenin, esittelyn myötä alamme nähdä tärkeän ongelman orgaanisissa molekyyleissä: valinnat. Kun C-atomeita on neljä, C-C-kaksoissidos voi mennä ensimmäisen ja toisen C-atomin väliin tai toisen ja kolmannen C-atomin väliin:
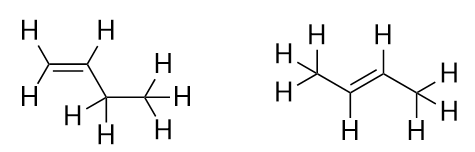
(Kolmannen ja neljännen C-atomin välissä oleva kaksoissidos on sama kuin ensimmäisen ja toisen C-atomin välissä oleva kaksoissidos, mutta se on vain käännetty ylösalaisin). Orgaanisen kemian nimeämissäännöt edellyttävät, että näillä kahdella aineella on eri nimet. Ensimmäisen molekyylin nimi on but-1-eeni, kun taas toisen molekyylin nimi on but-2-eeni. Vanhemman ketjun nimen ja loppuliitteen välissä olevaa numeroa kutsutaan paikannimeksi, ja se osoittaa, mistä hiilestä kaksoissidos on peräisin. Molekyylin ominaisuuden numeroinnissa käytetään pienintä mahdollista numeroa, joten toisen molekyylin kutsuminen but-3-eeniksi olisi virheellistä. Numerot ovat yleisiä orgaanisten kemiallisten nimien osia, koska ne osoittavat, mikä C-atomi ketjussa sisältää erottuvan ominaisuuden. Kun kaksoissidos (tai muu funktionaalinen ryhmä) sijaitsee ensimmäisellä hiilellä, joillakin kirjoittajilla on tapana jättää paikannimi pois. Jos esimerkiksi buteeni kirjoitettaisiin ilman paikannimeä, sinun pitäisi olettaa, että se viittaa but-1-eeniin, ei but-2-eeniin.
Yhdisteillä but-1-eeni ja but-2-eeni on erilaiset fysikaaliset ja kemialliset ominaisuudet, vaikka niillä on sama molekyylikaava-C4H8. Erilaisia molekyylikaavaltaan samanlaisia molekyylejä kutsutaan isomeereiksi. Isomeerit ovat yleisiä orgaanisessa kemiassa ja lisäävät sen monimutkaisuutta.
Esimerkki 1
Ehdota buteenimolekyylien nimien perusteella nimi tälle molekyylille.
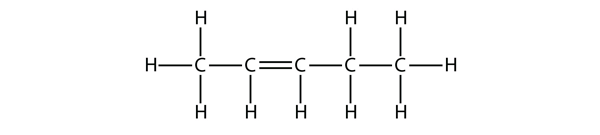
Ratkaisu
Viidellä C-atomilla käytämme penteeni-alkenin nimeä, ja C-C-kaksoissidoksella tämä on alkeeni, joten tämä molekyyli on penteeni. C-atomien numeroinnissa käytämme numeroa 2, koska se on pienin mahdollinen merkintä. Tämän molekyylin nimi on siis pent-2-eeni.
Kokeile itseäsi
Ehdota tälle molekyylille nimeä buteenimolekyylien nimien perusteella.
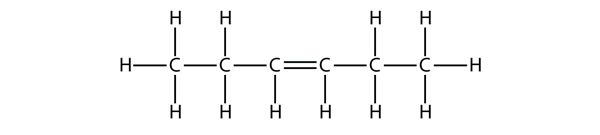
Vastaus
hex-3-eeni
Alkyynejä, joissa on C-C-kolmoissidos, nimetään samalla tavalla kuin alkeenit, paitsi että niiden nimet päättyvät -yneeseen. Pienin alkyyni on etyyni, joka tunnetaan myös nimellä asetyleeni:
![]()
Propyyni on rakenteeltaan seuraavanlainen:
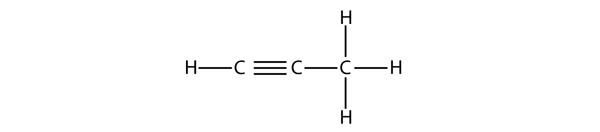
Butyynin kohdalla on aloitettava kolmoissidoksen aseman numerointi, aivan kuten alkeenien kohdalla:
Bentseeni on aromaattinen yhdiste, joka koostuu kuuden C-atomin muodostamasta renkaasta, jossa vuorottelevat yksi- ja kaksoissidokset C-C:
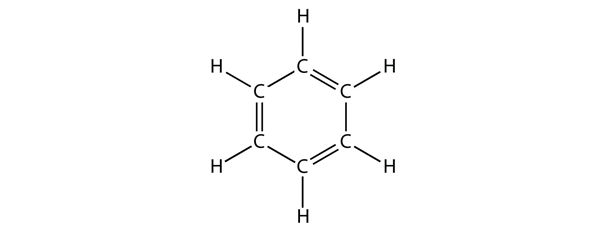
Vuorottelevat yksi- ja kaksoissidokset C-C:n välillä antavat bentseenirenkaalle erityistä stabiilisuutta, eikä se reagoi alkeenin tapaan, niin kuin voisi olettaa.
Niin perustavanlaatuisia kuin hiilivedyt ovatkin orgaanisen kemian kannalta, niiden ominaisuudet ja kemialliset reaktiot ovat melko arkipäiväisiä. Useimmat hiilivedyt ovat poolittomia C- ja H-atomien läheisen elektronegatiivisuuden vuoksi. Näin ollen ne liukenevat vain vähän H2O:han ja muihin polaarisiin liuottimiin. Pienet hiilivedyt, kuten metaani ja etaani, ovat kaasuja huoneenlämmössä, kun taas suuremmat hiilivedyt, kuten heksaani ja oktaani, ovat nesteitä. Vielä suuremmat hiilivedyt, kuten hentriokvantaani (C31H64), ovat huoneenlämmössä kiinteitä aineita, joiden koostumus on pehmeä ja vahamainen.
Hiilivedyt ovat melko reagoimattomia, mutta ne osallistuvat joihinkin klassisiin kemiallisiin reaktioihin. Yksi yleinen reaktio on substituutio halogeeniatomilla yhdistämällä hiilivety ja alkuaineena oleva halogeeni. Joskus valoa käytetään edistämään reaktiota, kuten tässä metaanin ja kloorin välisessä reaktiossa:
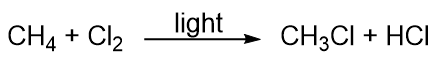
Halogeenit voivat reagoida myös alkeenien ja alkyynien kanssa, mutta reaktio on erilainen. Näissä tapauksissa halogeenimolekyylit reagoivat C-C-kaksois- tai kolmoissidoksen kanssa ja kiinnittyvät kuhunkin monisidokseen osallistuvaan C-atomiin. Tätä reaktiota kutsutaan additioreaktioksi. Yksi esimerkki on
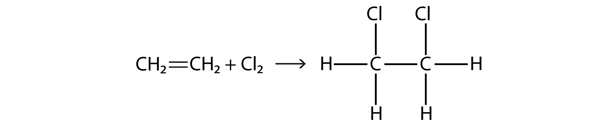
Reaktio-olosuhteet ovat yleensä mietoja; monissa tapauksissa halogeeni reagoi spontaanisti alkeenin tai alkiinin kanssa.
Vetyä voidaan myös lisätä monisidoksen yli; tätä reaktiota kutsutaan vetykehitysreaktioksi. Tällöin reaktio-olosuhteet eivät kuitenkaan välttämättä ole leudot; H2-kaasun suuret paineet voivat olla tarpeen. Yleensä käytetään platina- tai palladiumkatalyyttiä, jotta reaktio saadaan etenemään kohtuullisella nopeudella:
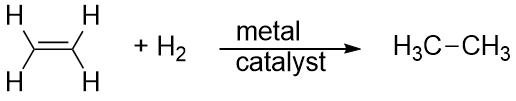
Hiilivetyjen ylivoimaisesti yleisin reaktio on palaminen, jossa hiilivety yhdistyy O2:n kanssa CO2:ksi ja H2O:ksi. Hiilivetyjen palamiseen liittyy energian vapautuminen, ja se on yhteiskuntamme ensisijainen energiantuotannon lähde (kuva 16.2 ”Palaminen”). Esimerkiksi bensiinin, jota voidaan esittää C8H18:lla, palamisreaktio on seuraava:
2 C8H18 + 25 O2 → 16 CO2 + 18 H2O + ~5060 kJ
Kuva 16.2 Palaminen

.