Kemiallinen alkuaine kloori luokitellaan halogeeniin ja ei-metalliin. Sen löysi Carl Wilhelm Scheele vuonna 1774.

Tietovyöhyke
| Luokitus: | Kloori on halogeeni ja epämetalli | |
| Väri: | vihertävän keltainen | |
| Atomipaino: | 35.453 | |
| Tila: | kaasu | |
| Sulamispiste: | -101 oC , 172 K | |
| Kiehumispiste: | -34 oC , 239 K | |
| Elektronit: | 17 | |
| Protonit: | 17 | |
| Runsaimman isotoopin neutronit: | 18 | |
| Elektronikuoret: | 2,8,7 | |
| Elektronikonfiguraatio: | 1s2 2s2 2p6 3s2 3p5 | |
| Tiheys @ 20oC: | 0.003214 g/cm3 |
Näytä lisää, mm: Lämmöt, energiat, hapettuminen, reaktiot,
yhdisteet, säteet, johtavuudet
| Atomitilavuus: | 22.7 cm3/mol |
| Rakenne: | Cl2:n kerroksia kiinteässä |
| Kovuus: | |
| Ominaislämpökapasiteetti | 0.48 J g-1 K-1 |
| Fuusiolämpö | 6.406 kJ mol-1 Cl2 |
| Atomisointilämpö | 122 kJ mol-1 |
| Höyrystymislämpö | 20.41 kJ mol-1 Cl2 |
| 1. ionisaatioenergia | 1251.1 kJ mol-1 |
| 2. ionisaatioenergia | 2297.3 kJ mol-1 |
| 3. ionisaatioenergia | 3821.8 kJ mol-1 |
| Elektroniaffiniteetti | 349 kJ mol-1 |
| Minimi hapetusluku | -1 |
| Min. yhteinen hapetusluku | -1 |
| Suurin hapetusluku | 7 |
| Max. yhteinen hapetusluku. | 7 |
| Elektronegatiivisuus (Paulingin asteikko) | 3.16 |
| Polarisoituvuusmäärä | 2.2 Å3 |
| Reaktio ilman kanssa | ei ole |
| Reaktio 15 M HNO3:n kanssa | lievä, ⇒ HClOx, NOxCl, NOx |
| Reaktio 6 M HCl:n kanssa | lievä, ⇒ HOCl, Cl- |
| Reaktio 6 M NaOH:n kanssa | lievä, ⇒ OCl-, Cl- |
| Oksidi(t) | Cl2O, ClO2, Cl2O7 |
| Hydridi(t) | HCl |
| Kloridi(t) | Cl2 |
| Atomisäde | 100 pm |
| Ioninen säde (1+-ioni) | – |
| Ionisäde (2+-ioni) | – |
| Ionisäde (3+-ioni) | – |
| Ionisäde (1- ioni) | 167 pm |
| Ionisäde (2-ioni) | – |
| Ionisäde (3-ioni) | – |
| Lämmönjohtavuus | 0.0089 W m-1 K-1 |
| Sähkönjohtavuus | – |
| Jäätymis-/ sulamispiste: | -101 oC , 172 K |

Kloori koeputkessa (Kuva: Ben Mills)
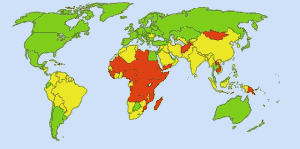
Turvallinen juomavesi: Kuva: Ionut_Cojocaru. Viheralueilla jokainen voi saada turvallista vettä. Punaisilla alueilla vähintään 25 prosenttia ihmisistä ei saa käsiteltyä vettä. Keltaiset alueet ovat välimaastossa. Ennen kuin klooria alettiin käyttää rutiininomaisesti Yhdysvaltain vesihuollossa, lavantauti vaati vuosittain 25 000 kuolonuhria. Nykyään 98 prosenttia julkisista vesihuoltolaitoksista käsitellään kloorilla tai klooriyhdisteellä. Lavantauti vaatii nyt keskimäärin yhden uhrin vuodessa. (4)

Carl Wilhelm Scheele, joka löysi kloorin vuonna 1774.
Kloorin löytäminen
Klooria valmisti ensimmäisen kerran Carl Wilhelm Scheele Ruotsissa vuonna 1774. Scheele keräsi kaasun, joka vapautui pyrolusiitin reagoidessa spiritus saliksen kanssa – alkemistinen termi, joka tarkoittaa suolan henkeä/hengitystä. Uudella kaasulla oli Scheelen mukaan ”hyvin tuntuva tukahduttava haju, joka oli erittäin ahdistava keuhkoille… ja antaa vedelle hieman happaman maun… siinä oleva ilma saa keltaisen värin…”. (1)
Scheele totesi myös valmistamansa uuden kaasun korkean reaktiivisuuden ja valkaisevuuden: ”…kaikki metallit hyökkäsivät… kiinteät emäkset muuttuivat keittosuolaksi… kaikki kasvikukat – punaiset, siniset ja keltaiset – muuttuivat lyhyessä ajassa valkoisiksi; sama tapahtui myös vihreille kasveille… hyönteiset kuolivat välittömästi. (1)
Havaintojensa tarkkuudesta huolimatta Scheele luuli virheellisesti, että uusi kaasu oli muraattihapon deflostiganoitu muoto.
Kuuluisa ranskalainen kemisti Antoine Lavoisier oli sitä mieltä, että uutta kaasua pitäisi kutsua nimellä oksimuraattihappo perustuen vielä löytämättömään alkuaineeseen muriumiin. (2)
* Sekaannus kloorin todellisesta identiteetistä johtui flogistoniteoriasta; kemistit olivat hyväksyneet flogistonin lähes koko 1700-luvun ajan – kunnes Lavoisier itse kumosi sen. Phlogiston oli ”aine”, jota käytettiin selittämään silloin selittämätöntä. Kätevästi sillä oli negatiivinen paino silloin, kun sitä tarvittiin, ja se ”selitti” reaktioita, kuten ruostumista ja palamista.
Lavoisier oli flogistonin kaatumisen arkkitehti osoittamalla, että hapen kemia oli parempi selitys kemiallisissa reaktioissa kuin flogistoni oli. (3)
Vuoteen 1810 mennessä tieteellinen konsensus oli, että alkuaine, jota nyt kutsumme klooriksi, oli itse asiassa yhdistelmä, joka sisälsi happea. Englantilainen kemisti Sir Humphry Davy havaitsi, että konsensus oli väärässä; hän ei saanut uutta kellanvihreää kaasua reagoimaan puuhiilielektrodin kanssa, mikä sai hänet uskomaan, että se ei ehkä sisällä happea. Fosforin ja ammoniakin kanssa tehdyissä reaktioissa hän osoitti, että uusi kaasu ei sisältänyt happea. Hän käytti valtavaa, 2000 levyistä volttikasaa nähdäkseen, voisiko kaasun fosfori- ja rikkiyhdisteistä irrottaa happea, mutta jälleen hän ei löytänyt happea. (1a)
Vuonna 1811 Davy päätteli, että uusi kaasu oli itse asiassa uusi alkuaine. (1b) Hän nimesi sen klooriksi kreikankielisestä sanasta ”chloros”, joka tarkoittaa vaaleanvihreää tai kellanvihreää.
Interesting Facts about Chlorine
- Ensimmäinen löydetty ketjureaktio ei ollut ydinreaktio, vaan se oli kemiallinen ketjureaktio. Sen löysi vuonna 1913 Max Bodenstein, joka näki kloori- ja vetykaasujen seoksen räjähtävän valon laukaisemana. Walther Nernst selitti ketjureaktiomekanismin täydellisesti vuonna 1918.
- Maailman valtameret sisältävät runsaasti klooria. Jos tämä kloori vapautuisi kaasuna, sen paino olisi 5x suurempi kuin maapallon koko nykyinen ilmakehä. (Valtamerissämme on noin 2,6 x 1016 metristä tonnia klooria, enimmäkseen natriumkloridina.)
- Klooria ei ole runsaasti vain valtamerissämme, vaan se on kuudenneksi yleisin alkuaine maapallon kuoressa.
- Altistuminen pienille määrille klooria lyhyenkin ajan voi olla tappavaa. Kuolemantapauksia on odotettavissa, kun ilmassa on 1 osa klooria tuhannesta (tai joskus vieläkin pienemmillä pitoisuuksilla). (5)
- Kloori on ilmaa raskaampaa. Vapautuessaan se muodostaa myrkyllisen peitteen, joka kulkee tuulen mukana. Klooria käytettiin kemiallisena aseena ensimmäisessä maailmansodassa, ensin Saksan armeija vuonna 1915 ja sitten länsiliittoutuneet. Se ei ollut niin ”tehokas” kuin toivottiin, koska kloori havaitaan helposti sen voimakkaan hajun perusteella. Se on myös vesiliukoinen, joten sotilaat pystyivät suojautumaan sen pahimmilta vaikutuksilta hengittämällä sitä kosteiden kankaiden läpi.

Esimerkit ja luonteenomaiset piirteet
Haitalliset vaikutukset:
Kloori on myrkyllinen kaasu, joka ärsyttää ihoa, silmiä ja hengityselimiä.
Ominaisuudet:
Kloori on vihertävänkeltainen, kaksiatominen, tiheä kaasu, jolla on terävä haju (valkaisuaineen haju).
Klooria ei esiinny vapaana luonnossa, koska se yhdistyy helposti lähes kaikkien muiden alkuaineiden kanssa.
Klooria esiintyy luonnossa pääasiassa keittosuolana (NaCl), karnaliittina , ja sylviittinä (KCl).
Nestemäisessä ja kiinteässä olomuodossaan se on voimakas valkaisu-, hapetus- ja desinfiointiaine.
Kloorin käyttötarkoitukset
Klooria käytetään turvallisen juomaveden tuottamiseen.
Klooriyhdisteitä käytetään enimmäkseen saniteettitilojen puhdistuksessa, massan valkaisussa, desinfiointiaineena ja tekstiilien käsittelyssä.
Klooria käytetään myös kloraattien valmistukseen ja se on tärkeä orgaanisessa kemiassa muodostaen yhdisteitä, kuten kloroformia, hiilitetrakloridia, polyvinyylikloridia ja synteettistä kumia.
Klooriyhdisteiden muita käyttökohteita ovat muun muassa väriaineet, öljytuotteet, lääkkeet, antiseptiset aineet, hyönteismyrkyt, elintarvikkeet, liuottimet, maalit ja muovit.
Runsaus ja isotoopit
Runsaus maankuori: 145 miljoonasosaa painossa, 85 miljoonasosaa mooleissa
Runsaus aurinkokunta: 8 miljoonasosaa painossa, 0,3 miljoonasosaa mooleissa
Kustannus, puhdas: 0,15 $/100g
Kustannus, irtotavarana: $/100g
Lähde: Kloorikaasua tuotetaan kaupallisesti elektrolyysillä natriumkloridista (NaCl) merivedestä tai suolakaivosten suolavedestä.
Isotoopit: Kloorilla on 16 isotooppia, joiden puoliintumisajat tunnetaan ja joiden massanumerot ovat 31-46. Luonnossa esiintyvä kloori on kahden stabiilin isotooppinsa 35Cl:n ja 37Cl:n seos, joiden luonnolliset esiintyvyydet ovat 75,8 % ja 24,3 %.

- Henry M. Leicester, Herbert S. Klickstein, A Source Book in Chemistry, 1400-1900., (1969) Harvard University Press. s. 111; 1a. s. 241.; 1b. s. 257.
- J.W. Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry., 1922, vol 2, Longmans, Green and Co., s. 21.
- Antoine Lavoisier, Memoires de l’ Academie royale des sciences 1783., 1786, s. 505-538.
- The Chlorine Tree.
- OSHA, Occupational Safety and Health Guideline for Chlorine.
Lainaa tätä sivua
Verkkolinkitystä varten kopioi ja liitä jompikumpi seuraavista:
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine</a>
tai
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine Element Facts</a>
Jos haluat siteerata tätä sivua akateemisessa asiakirjassa, käytä seuraavaa MLA:n mukaista viittaustapaa:
"Chlorine." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/chlorine.html>.