ABSTRACT: HIV:n hoitoon käytettävissä olevat antiretroviraaliset (ARV) lääkkeet ovat laajentuneet vuodesta 2018 lähtien. On hyväksytty uudentyyppisiä ARV-lääkkeitä, joilla on uusia vaikutusmekanismeja, kuten ibalitsumab-uiyk ja fostemsaviiri. Myös aiemmin saatavilla olleiden lääkkeiden yhdistelmätabletteja, kuten biktegraviiri/emtrisitabiini/tenofoviirialafenamidi ja dolutegraviiri/lamivudiini, on hyväksytty. Lisäksi aiemmin saatavilla olleiden ARV-lääkkeiden hyväksytyt käyttöaiheet ovat laajentuneet, kuten emtrisitabiini/tenofoviirialafenamidin käyttö altistumista edeltävässä ennaltaehkäisyssä.
US Pharm. 2020:45(10):17-25.
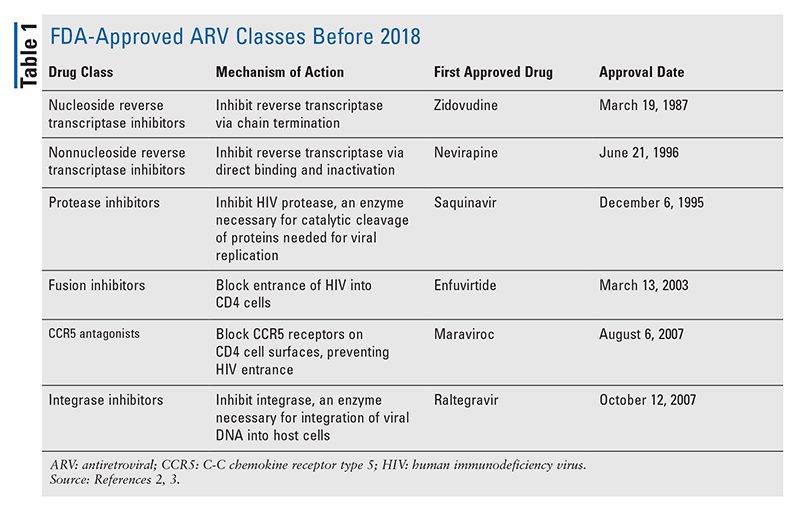
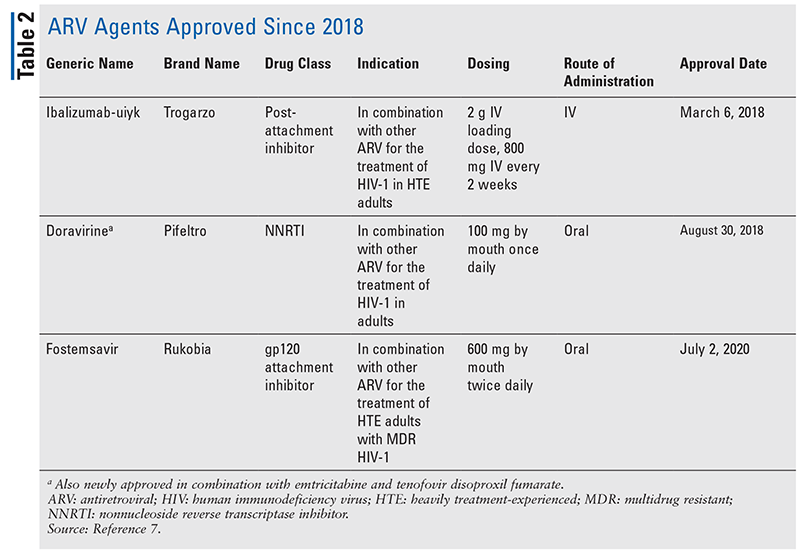
Hiv:n hoidossa käytettävien antiretroviraalisten (ARV) lääkeaineiden peruspilarit ovat jo vuosia koostuneet pitkälti samoista kourallisista lääkeryhmistä. HIV:n hoitoa kokeiltiin ensimmäisen kerran nukleosidien käänteistranskriptaasin estäjillä (NRTI), jotka olivat ensimmäinen FDA:n hyväksymä ARV-lääkeryhmä. Vähitellen löydettiin yhä useampia luokkia, ja niitä alettiin käyttää erilaisissa, usein monimutkaisissa hoito-ohjelmissa (TAULUKKO 1).1-3 Sen jälkeen, kun raltegraviiri hyväksyttiin vuonna 2007, uusien HIV-lääkkeiden hyväksynnät koskivat suurelta osin saatavilla olevien lääkkeiden uudelleenkäyttöä ja uusia yhdistelmälääkkeitä. Tämä muuttui vuonna 2018, kun ibalitsumab-uiyk hyväksyttiin, joka on ensimmäinen uusi ARV-lääke yli vuosikymmeneen.4 Ibalitsumab-uiykia seurasi nopeasti uusi ei-nukleosidinen käänteistranskriptaasin estäjä (NNRTI), doraviriini, myöhemmin samana vuonna ja uusi kiinnittymisen estäjä, fostemsaviiri, vuonna 2020 (TAULUKKO 2).5-7
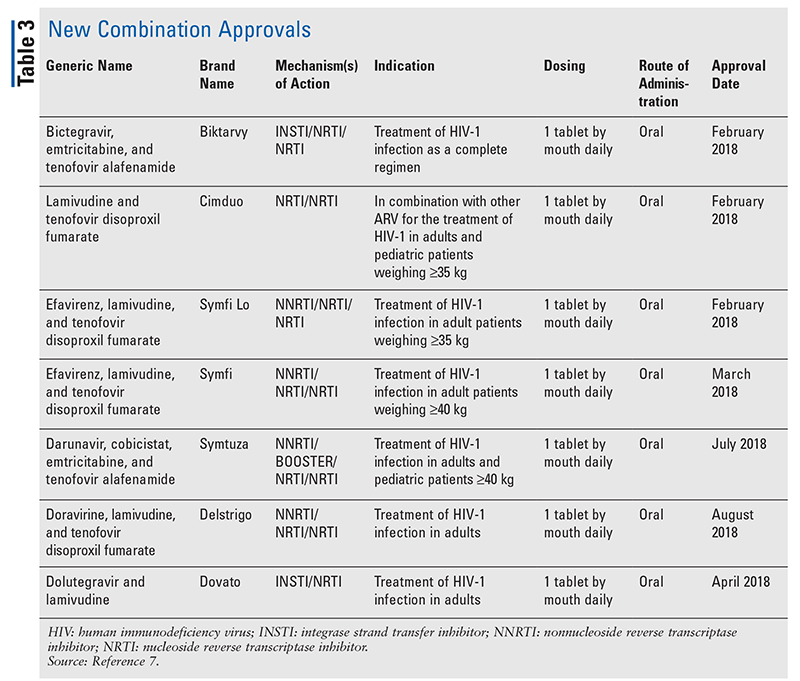
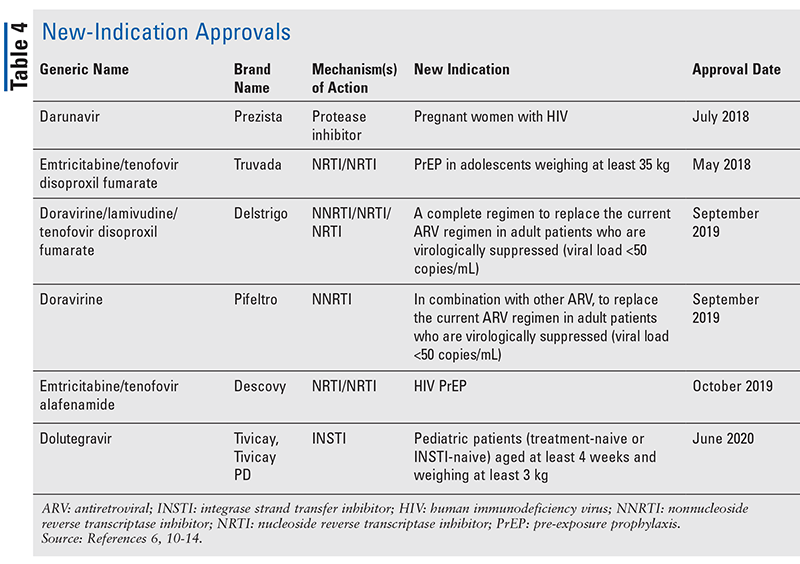
Vaikka uudet lääkkeet ovatkin usein jännittävimpiä uusista lääkevalmistehyväksynnästä annetuista lääkehyväksynnöistä, antorajoitteiset virustorjuntahoidot ovat kuitenkin myös parantuneet muilla tavoin. Kun otetaan huomioon monien HIV-hoitojen valtava tablettitaakka, äskettäin hyväksytyt yhdistelmäehkäisyvalmisteet (TAULUKKO 3) voivat helpottaa potilaiden elämää huomattavasti. Tällaisten lääkkeiden käyttö ja tarvittavan pilleritaakan rajoittaminen ovat osoittaneet parantaneensa hoitoon sitoutumista ja kokonaistuloksia.8,9 Myös aiemmin saatavilla olleiden ARV-lääkkeiden hyväksyttyjä käyttöaiheita on laajennettu (TAULUKKO 4), mikä tarjoaa uusia vaihtoehtoja tietyille potilasryhmille ja tietyissä käyttöaiheissa.10-14

Vaikka vuodesta 2018 lähtien uusia hyväksyntöjä on tullut paljon, tässä artikkelissa esitellään neljä vastikään hyväksyttyä lääkevalmistetta ja yksi uusi käyttöaihe. Nämä hyväksynnät valittiin havainnollistamaan otos saataville tulevien uusien lääkkeiden laajasta valikoimasta sekä korostamaan joitakin uusia vaihtoehtoja, jotka tarjoavat ainutlaatuisen mahdollisuuden HIV:n hoidossa.
Ibalitsumabi-Uiyk (Trogarzo)
Ibalitsumabi-Uiyk on injektoitava rekombinantti monoklonaalinen vasta-aine, joka sitoutuu CD4-solujen pintaproteiineihin johtaen konformaatiomuutoksiin, jotka estävät HIV-1:n fuusioitumiseen vaadittavat post-attachment-askeleet, jotta HIV-1:n fuusio voi tapahtua ja se voi kulkeutua solun sisään. Se on ainoa monoklonaalinen lääke, jota käytetään HIV:n hoidossa. Ainutlaatuisen sitoutumispesifisyytensä ansiosta ibalitsumab-uiyk estää viruksen tunkeutumisen aiheuttamatta immunosuppressiota, mikä on monien monoklonaalisten lääkkeiden ongelma.4,15 Se on tarkoitettu yhdistelmähoitona muiden ARV-lääkkeiden kanssa hoidettavaksi runsaasti hoitoa saaneille aikuisille, jotka sairastavat moniresistenttiä (MDR) HIV-1:tä ja joiden nykyinen ARV-hoito ei auta.4
Ibalitsumab-uiykin hyväksyntä perustui tutkimukseen, joka tehtiin 40 HTE-hiv-potilaalla, joiden viruskuorma oli yli 1 000 kopiota/ml ja joilla oli dokumentoitu resistenssi vähintään yhdelle NRTI:lle, NNRTI:lle ja proteaasinestäjälle. Potilailta edellytettiin myös vähintään 6 kuukauden hoitoa ja äskettäin epäonnistunutta hoitoa. Tutkimus sisälsi kolme jaksoa, jotka alkoivat 6 päivän jaksolla, jolloin viruksen peruskuormitus määritettiin ja vahvistettiin (kontrollijakso). Päivänä 7 potilaat saivat 2 000 mg:n aloitusannoksen ibalitsumab-uiykia tavanomaisen ART-hoidon lisäksi (toiminnallinen monoterapiajakso). Päivänä 14 viruskuormitus arvioitiin uudelleen, ja hoitoja seurattiin ja säädettiin, jotta varmistettiin asianmukainen aktiivisuus heidän HIV-infektiotaan vastaan. Ibalizumab-uiyk 800 mg annettiin laskimoon 2 viikon välein tutkimuksen loppuun asti (ylläpitojakso). Ensisijaisessa päätetapahtumassa arvioitiin viruskuorman vähenemisen osuuden eroa kontrollijaksosta funktionaalisen monoterapian jaksoon, erityisesti vertaamalla niiden potilaiden prosenttiosuutta, joiden kokonaisviruskuorma laski ³0,5 log10. Kontrollijakson aikana tällainen lasku havaittiin 3 prosentilla potilaista, kun taas funktionaalisen monoterapian aikana 83 prosentilla potilaista saavutettiin ilmoitettu viruskuorman lasku. 25 viikon lopussa 43 % potilaista saavutti viruskuorman <50 kopiota/ml.16
Tämän tutkimuksen perusteella ibalitsumab-uiyk:n hyväksytty annostelu on 2 000 mg:n kertaluonteinen infuusiolatausannos, jota seuraa 800 mg:n infuusiolatausannos ylläpitokäyttöön kahden viikon välein.4,16 Ensimmäisen infuusion antamisen jälkeen infuusioon liittyvien reaktioiden varalta edellytetään huolellista tarkkailua ensimmäisen tunnin ajan, ja myöhempää infuusion tarkkailua vähennetään viiteentoista minuuttiin alkuannoksen siedättämisen jälkeen.4 Ibalitsumab-uiyk näyttää olevan muutoin hyvin siedetty; ibalitsumab-uiykiin liittyneistä haittavaikutuksista yleisimmät olivat pahoinvointi, huimaus ja ripuli.4,16
Fostemsaviiri (Rukobia)
Fostemsaviiri on uusi ARV-lääke, joka on tarkoitettu yhdistelmähoitoon HTE-aikuisille, joilla on tunnetusti MDR HIV-1, erityisesti potilaille, joilla nykyinen ART ei tehoa mahdollisen resistenssin, intoleranssin tai turvallisuusnäkökohtien vuoksi.4 Se on ensimmäinen FDA:n hyväksymä kiinnittymisen estäjä. Kun se on entsymaattisesti aktivoitunut aktiiviseksi molekyyliksi temsaviiriksi, se sitoutuu gp120:een, viruskuoren glykoproteiiniin, joka on välttämätön viruksen kiinnittymiselle CD4-soluihin. Tämä estää viruksen pääsyn CD4-soluihin ja pysäyttää tehokkaasti viruksen lisääntymisen. Tämän uudenlaisen mekanismin vuoksi on epätodennäköistä, että fostemsaviiri aiheuttaisi itselleen resistenssiä useimpiin muihin ARV-lääkkeisiin liittyvän valikoivan paineen kautta.6,17
Fostemsaviirin turvallisuutta ja tehoa arvioitiin satunnaistetussa, kaksoissokkoutetussa, plasebokontrolloidussa kliinisessä tutkimuksessa (BRIGHTE), johon osallistui 371 HI-virusinfektiota saanutta HTE-hiv-1-potilasta.16,17 Pääkohorttiin kuuluvia potilaita hoidettiin molemmilla perustason ART-hoidoilla sekä joko fostemsaviirilla 600 mg kahdesti vuorokaudessa tai lumelääkkeellä yhteensä 8 päivän ajan. Arvioinnissa 8. päivänä fostemsaviiripotilaiden seerumin HIV-RNA-viruspitoisuudet olivat huomattavasti alhaisemmat. Tämän ensimmäisen hoitojakson jälkeen kaikki potilaat siirrettiin käyttämään fostemsaviiria 600 mg kahdesti päivässä. 24 viikon kohdalla 53 %:lla tutkimukseen osallistuneista saavutettiin tosiasiallisesti havaitsematon virussuppressio, ja suppressio parani 60 %:iin viikolla 96.17,18
Yleisimmin raportoitu fostemsaviirin haittavaikutus oli pahoinvointi. Vakavampia reaktioita, mukaan lukien maksaentsyymien kohoamista, raportoitiin potilailla, joilla oli B- tai C-hepatiitin samanaikainen infektio.17,18 Muissa tutkimuksissa raportoitiin vähäisiä päänsäryn, ihottuman ja ripulin esiintyvyyksiä. Aktiivinen metaboliitti temsaviiri metaboloituu CYP3A4:n välityksellä, joten voimakkaita induktoreita, kuten karbamatsepiinia, rifampiinia ja mäkikuismaa, on vältettävä seerumin temsaviiripitoisuuden pienenemisen estämiseksi.17-19
Biktegraviiri/emtrisitabiini/tenofoviirialafenamidi (Biktarvy)
Biktegraviiri/emtrisitabiini/tenofoviirialafenamidi (BIC/FTC/TAF) on kiinteäannoksinen, kerran vuorokaudessa otettava yhdistelmätabletti, joka sisältää uudenlaista integraasin estäjää ja kahta nukleosidi/nukleotidi-käänteistranskriptaasin estäjää. Biktarvyn yksittäiset komponentit ovat biktegraviiri 50 mg (integraasiketjun siirtymisen estäjä ), emtrisitabiini 200 mg (NRTI) ja tenofoviirialafenamidi 25 mg (NRTI). BIC/FTC/TAF on tarkoitettu täydelliseksi hoidoksi HIV-1-infektoituneille aikuisille, joilla ei ole aiemmin ollut ART-hoitoa, tai korvaamaan nykyistä ART-hoitoa potilailla, jotka ovat virologisesti suppressoituneita (viruskuorma £ 50 kopiota millilitrassa) vakaalla ARV-valmisteella vähintään 3 kuukauden ajan ja joilla ei ole aiemmin ollut hoidon epäonnistumista tai resistenssiä sen yksittäisille aineosille. Merkittävintä on, että se on yhden pillerin täydellinen hoito, joka ei vaadi muita ARV-lääkkeitä.20
BIC/FTC/TAF hyväksyttiin vuonna 2018 neljän kliinisen tutkimuksen jälkeen. Kahdessa kliinisessä tutkimuksessa testattiin BIC/FTC/TAF:n tehoa ja turvallisuutta potilailla, joilla ei ollut aiemmin ollut ART-hoitoa: Tutkimus 1489 (satunnaistettu, BIC/FTC/TAF vs. abakaviiri/olutegraviiri/lamivudiini, ja tutkimus 1490 (satunnaistettu, BIC/FTC/TAF vs.olutegraviiri + emtrisitabiini/tenofoviirialafenamidi ).21,22 Tutkimuksessa 1489 ensisijainen päätetapahtuma eli viruskuormitus <50 kopiota/ml saavutettiin 92 prosentissa BIC/FTC/TAF-ryhmässä ja 93 prosentissa ABC/DTG/3TC-ryhmässä (hoidon ero -0,6 %; 95 %:n luottamusväli , -4,8-3,6 %). Tutkimuksessa 1490 ensisijainen päätetapahtuma eli viruskuormitus <50 kopiota/ml saavutettiin 89 %:lla BIC/FTC/TAF-ryhmässä ja 93 %:lla DTG + FTC/TAF-ryhmässä (hoidon ero -3,5 %; 95 %:n luottamusväli, -7,9 % – 1,0 %).21,22
Kahdessa muussa tutkimuksessa testattiin BIC/FTC/TAF:n tehoa ja turvallisuutta virologisesti suppressoituneilla potilailla, jotka siirrettäisiin nykyisestä ART-hoidostaan BIC/FTC/TAF:ään: Tutkimus 1844 (satunnaistettu, siirtyminen dolutegraviirista ja abakaviirista/lamivudiinista tai ABC/DTG/3TC:stä BIC/FTC/TAF:ään) ja tutkimus 1878 (avoin, siirtyminen atatsanaviirista tai tehostetusta darunaviirista ja abakaviirista/emtrisitabiinista tai emtrisitabiinista/tenofoviiridisoproksiilifumaraatista BIC/FTC/TAF:ään).23,24 Tutkimuksessa 1844 ensisijainen päätetapahtuma, eli potilaat, jotka menettivät virologisen suppressiotilanteen (viruskuorma ³50 kopiota millilitrassa), todettiin 1 prosentilla BIC/FTC/TAF-ryhmässä ja <1 prosentilla alkuperäisen hoitomuodon ryhmässä (hoidon ero 0,7 %, 95 %:n CI, -1,0 % – 2,8 %). Tutkimuksessa 1878 ensisijainen päätetapahtuma, eli potilaat, jotka menettivät virologisen suppressiotilanteen, todettiin 2 %:lla BIC/FTC/TAF-ryhmässä ja 2 %:lla alkuperäisen hoitomuodon ryhmässä (hoidon ero 0,0 %, 95 %:n CI, -2,5 %:sta 2,5 %:iin).23,24
BIC/FTC/TAF annostellaan kerran vuorokaudessa suun kautta ruoan kanssa tai ilman ruokaa. Yleisimmin raportoidut haittavaikutukset, joita potilailla havaittiin, olivat ripuli, pahoinvointi ja päänsärky.20-24
Dolutegraviiri/Lamivudiini (Dovato)
Kombinaatio dolutegraviiri/lamivudiini (DTG/3TC), INSTI ja NRTI, hyväksyttiin vuonna 2019. Se on ensimmäinen kaksi lääkettä sisältävä, kiinteäannoksinen kokonaishoito HIV-1-infektion hoitoon hoitoa saamattomilla aikuispotilailla. Tämä poikkeaa perinteisesti vaadituista kolmen lääkkeen vakiohoitovaihtoehdoista. Tämä voi tarjota mahdollisuuden potilaille, jotka eivät voi sietää mitään yleisimmistä kolmen lääkkeen hoitojärjestelyistä haittavaikutusten tai väistämättömien lääkkeiden yhteisvaikutusten vuoksi.25,26.
Dolutegraviiri/lamivudiini-yhdistelmän teho ja turvallisuus osoitettiin kahdessa samanlaisessa tutkimuksessa, GEMINI-1:ssä ja GEMINI-2:ssa.27 Näihin tutkimuksiin osallistui yhteensä 1 433 HIV-1-infektoitunutta, hoitoa saamatonta aikuista, jotka satunnaistettiin saamaan kahden lääkkeen hoitoohjelmaa, dolutegraviiri 50 mg plus lamivudiini 150 mg, tai kolmen lääkkeen hoitoohjelmaa, dolutegraviiri plus emtrisitabiini plus tenofoviiridisoproksiilifumaraatti. Ensisijainen päätetapahtuma eli viruskuorman <50 kopiota/ml saavuttaminen osoitti, että DTG/3TC ei ollut huonompi – 91 %:lla 716:sta kahden lääkkeen potilaasta ja 93 %:lla 717:stä kolmen lääkkeen potilaasta (hoidon ero -1,7 %; 95 %:n CI, -4,4 %-1,1 %) – kun näiden kahden tutkimuksen tulokset yhdistettiin. Yhdistetyt tutkimukset osoittivat myös, että lääkkeeseen liittyviä haittatapahtumia oli lukumääräisesti vähemmän potilailla, joilla käytettiin kahden lääkkeen hoitoa, kuin potilailla, joilla käytettiin kolmen lääkkeen hoitoa (126 potilasta 716:sta ja 169 potilasta 717:stä). Koska teho ei ollut huonompi ja siedettävyysprofiili oli samankaltainen, terveysministeriö (Department of Health and Human Services) pystyi sisällyttämään kiinteäannoksisen DTG/3TC-yhdistelmävalmisteen HIV/AIDS-ohjeisiin suositelluksi aloitusvalmisteeksi useimmille hiv-tartunnan saaneille henkilöille.27
Dolutegraviiri/lamivudiini-yhdistelmäannos annostellaan kerran vuorokaudessa suun kautta ruuan kanssa tai ilman. Yleisimmät potilailla havaitut haittavaikutukset ovat päänsärky, pahoinvointi, ripuli, väsymys ja unettomuus. Vaikka kyseessä on kahden lääkkeen yhdistelmätabletti, sitä ei tarvitse antaa muiden ARV-lääkkeiden kanssa, koska se on täydellinen hoito-ohjelma.25-27.
Emtrisitabiini/tenofoviirialafenamidi altistumista edeltävään ennaltaehkäisyyn (PrEP)
Vuodesta 2012 lähtien ainoa FDA:n hyväksymä vaihtoehto PrEP:n toteuttamiseen on ollut FTC/TDF.11 Tämä muuttui vuonna 2019, kun emtrisitabiini/tenofoviirialafenamidi-yhdistelmävalmiste (FTC/TAF)13 hyväksyttiin, sillä se on rakenteeltaan samankaltainen yhdistelmävalmiste. Se on nyt tarkoitettu käytettäväksi PrEP:ssä infektoitumattomilla potilailla, joilla on suuri riski HIV:n tarttumiselle sukupuoliyhteyden kautta. Tämä ei koske potilaita, joilla on riski reseptiivisessä emätinyhteydessä, sillä tätä väestöryhmää ei ole vielä arvioitu.
PrEP:n hyväksyminen perustuu hiljattain tehtyyn DISCOVER-tutkimukseen, satunnaistettuun kaksoissokkotutkimukseen, jossa verrattiin FTC/TAF:ää ja tavanomaista FTC/TDF:ää siinä, miten ne vähensivät riskiä saada HIV-1-infektio miehillä ja transsukupuolisilla naisilla, jotka harrastavat seksiä miesten kanssa ja joilla on riski saada HIV-1-infektio.7 Tutkimus toteutettiin satunnaistettuna, kaksoissokkona, rinnakkaisryhmätutkimuksena, jonka seuranta-aika oli vähintään 48 viikkoa, ja vähintään 50 prosentilla osallistujista oli 96 viikon seuranta-aika satunnaistamisen jälkeen. Tutkimukseen osallistui 5 399 osallistujaa, jotka satunnaistettiin 1:1 jompaankumpaan ryhmään. Tutkimuksen ensisijaisena tavoitteena oli arvioida HIV-1-tartunnan ilmaantuvuutta 100 henkilötyövuotta kohti. FTC/TAF-haaran 2 694 osallistujan joukossa HIV-1-infektiota todettiin 7 potilaalla (0,16/100 henkilötyövuotta). FTC/TDF-haaran 2 693 osallistujan joukossa HIV-1-infektiota todettiin 15 potilaalla (0,34/100 henkilötyövuotta). Nämä ilmaantuvuudet osoittavat, että FTC/TAF ei ollut FTC/TDF:ää huonompi tutkimukseen osallistuneilla, jotka olivat vaarassa saada HIV:n, ja viime kädessä antoivat FDA:lle mahdollisuuden lisätä PrEP:n FTC/TAF:n käyttöaiheisiin.13
FTC/TAF:n paikka HIV:n hoidossa on todennäköisesti edelleen epäselvä. Vaikka sille on löytynyt käyttöä muilla HIV:n hoidon osa-alueilla, sen hyötyä vaihtoehtoon nähden tässä yhteydessä ei ole vielä lopullisesti määritetty. Vaikka TAF on samankaltainen, se saattaa tarjota vähemmän luuntiheyden muutoksia ja munuaisten toimintahäiriöitä, jotka ovat TDF:ään liittyviä haittavaikutuksia. Tätä eroa ei ole kuitenkaan vahvistettu hyvin, ja joidenkin tietojen mukaan tämä hyöty ei ehkä ole kliinisesti merkittävä, jos hoito ei sisällä farmakokineettistä tehosteainetta, kuten kobitsistaattia tai ritonaviiria. 27-29
Johtopäätös
HIV:n monimutkaisuuden ja mahdollisen resistenssin vuoksi ARV-hoidosta voi tulla potilaille nopeasti rasittavaa. Vuodesta 2018 tähän päivään asti lääketieteellinen yhteisö on nähnyt FDA:n hyväksymien HIV:n hoitoon tarkoitettujen ARV-hoitojen laajan laajentumisen. Näihin hoitoihin kuuluu uusia kiinteäannoksisia yhdistelmätabletteja, uusia lääkkeitä, jotka toimivat eri mekanismeilla kuin aiemmin markkinoilla olleet lääkkeet, ja jopa uusia käyttöaiheita aiemmin käytössä olleille lääkkeille. Nämä uudet lääkkeet ovat jo vaikuttaneet nykyisiin hoito-ohjeisiin, ja ne voivat auttaa potilaita elämään pidempään ja terveellisemmin.
Tämän artikkelin sisältö on tarkoitettu vain tiedoksi. Sisältöä ei ole tarkoitettu korvaamaan ammatillista neuvontaa. Tässä artikkelissa annettuihin tietoihin luottaminen tapahtuu yksinomaan omalla vastuullasi.
1. Vella S, Schwartländer B, Sow SP, et al. Antiretroviraalisen hoidon historia ja sen toteuttaminen resursseiltaan rajallisilla alueilla maailmassa. AIDS. 2012;26(10):1231-1241.
2. Arts EJ, Hazuda DJ. HIV-1:n antiretroviraalinen lääkehoito. Cold Spring Harb Perspect Med. 2012;2(4):a007161.
3. Chaudhuri S, Symons JA, Deval J. Innovaatiot ja suuntaukset viruslääkkeiden kehittämisessä ja hyväksymisessä: 1987-2017 ja sen jälkeen. Antiviral Res. 2018;155:76-88.
4. Trogarzo (ibalitsumab-uiyk) pakkausseloste. Montreal, Quebec: Theratechnologies Inc; maaliskuu 2018.
5. Pifeltro (doraviriini) pakkausseloste. Whitehouse Station, NJ: Merck & Co, Inc; maaliskuu 2019.
6. Rukobia (fostemsaviiri) pakkausseloste. Research Triangle Park, NC: GlaxoSmithKline; heinäkuu 2020.
7. Pan F, Chernew ME, Fendrick AM. Kiinteäannoksisten yhdistelmälääkkeiden vaikutus reseptilääkkeiden noudattamiseen. J Gen Intern Med. 2008;23(5):611-614.
8. Verma AA, Khuu W, Tadrous M,et al. Fixed-dose combination antihypertensive medications, adherence, and clinical outcomes: a population-based retrospective cohort study. PLoS Med. 2018;15(6):e1002584.
9. National Institutes of Health. HIVinfo. FDA:n hyväksymät HIV-lääkkeet. hivinfo.nih.gov/understanding-hiv/fact-sheet/fda-approved-hiv-medicines. Accessed September 22, 2020.
10. Prezista (darunaviiri) pakkausseloste. Titusville, NJ: Janssen Therapeutics; toukokuu 2019.
11. Truvada (emtrisitabiini/tenofoviiridisoproksiilifumaraatti) pakkausseloste. Foster City, CA: Gilead Sciences, Inc; kesäkuu 2004/2020.
12. Delstrigo (doraviriini/lamivudiini/tenofoviiridisoproksiilifumeraatti) pakkausseloste. White House Starion, NJ: Merck & Co, Inc; elokuu 2018.
13. Descovy (emtrisitabiini/tenofoviirialafenamidi) pakkausseloste. Foster City, CA: Gilead Sciences, Inc; joulukuu 2019.
14. Tivicayn (dolutegraviiri) pakkausseloste. Research Triangle Park, NC. GlaxoSmithKline; kesäkuu 2020.
15. Iacob SA, Iacob DG. CD4-reseptoreihin kohdistuva ibalitsumabi, uusi molekyyli HIV-hoidossa. Front Microbiol. 2017;8:2323.
16. Emu B, Fessel J, Schrader S, ym. ibalitsumabin vaiheen 3 tutkimus moniresistentin HIV-1:n hoidossa. N Engl J Med. 2018;379:645-654.
17. Li Z, Zhou N, Sun Y, ym. HIV-1-kiinnittymisen estäjän BMS-626529, aihiolääke BMS-663068:n aktiivisen komponentin, aktiivisuus CD4-riippumattomia viruksia ja muille sisäänpääsyn estäjille resistenttejä HIV-1-kuoria vastaan. Antimicrob Agents Chemother. 2013:57(9):4172-4180.
18. Kozal M, Aberg J, Pialoux G. Fostemsaviiri aikuisilla, joilla on moniresistentti HIV-1-infektio. N Engl J Med. 2020;382(13):1232-1243.
19. Cahn P, Fink V, Patterson P. Fostemsaviiri: uusi CD4-kiinnittymisen estäjä. Curr Opin HIV AIDS. 2018;13(4):341-345.
20. Biktarvy (biktegraviiri/emtritsitabiini/tenofoviirialafenamidi) pakkausseloste. Foster City, CA: Gilead Sceinces, Inc; helmikuu 2018.
21. Gallant J, Lazzarin A, Mills M, ym. bictegraviiri, emtrisitabiini ja tenofoviirialafenamidi verrattuna dolutegraviiriin, abakaviiriin ja lamivudiiniin HIV-1-infektion alkuhoidossa (GS-US-380-1489): kaksoissokkoutettu, monikeskuksinen, vaiheen 3 satunnaistettu, kontrolloitu, ei-konferenssitutkimus. Lancet. 2017;390(10107):2063-2072.
22. Sax PE, Pozniak A, Montes M, et al. Coformulated bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir with emtricitabine and tenofovir alafenamide, for initial treatment of HIV-1 infection (GS-US-380-1490): satunnaistettu, kaksoissokkoutettu, monikeskuksinen, vaiheen 3 ei-erinvertaisuuskontrolloitu tutkimus. Lancet. 2017;390(10107):2073-2082.
23. Malina JM, Ward D, Brar I, et al. Switching to fixed-dose bictegravir, emtrisitabine, and tenofovir alafenamide from dolutegravir plus abacavir andlamivudine in virologically suppressed adults with HIV-1 with virologically suppressed adults with HIV-1: 48 week results of a randomised, double-blind, multicentre, active-controlled, phase 3, non-inferiority trial. Lancet HIV. 2018;5(7):E357-E365.
24. Daar ES, De Jesus E, Ruane P, et al. Efficacy and safety of switching to fixed-dose bictegravir, emtricitabine, and tenofovir alafenamide from boosted protease inhibitor-based regimens in virologically suppressed adults with HIV-1: 48-week results of a randomised, open-label, multicentre, phase 3, non-inferiority trial. Lancet HIV. 2018;5(7):e347-e356.
25. Dovaton (dolutegraviiri/lamivudiini) pakkausseloste. Research Triangle Park, NC: GlaxoSmithKline. Maaliskuu 2020.
26. Scott LJ. Dolutegraviiri/lamivudiini yhden tabletin hoito: katsaus HIV-1-infektiossa. Lääkkeet. 2020;80(1):61-72.
27. Cahn P, Madero JS, Arribas JR, et al. GEMINI-tutkimusryhmä. Dolutegraviiri plus lamivudiini versus dolutegraviiri plus tenofoviiridisoproksiilifumaraatti ja emtrisitabiini antiretroviraalista HIV-1-infektiota sairastavilla antiretroviraalisesti naiiveilla aikuisilla (GEMINI-1 ja GEMINI-2): viikon 48 tulokset kahdesta monikeskuksisesta, kaksoissokkoutetusta, satunnaistetusta, ei-erinferioriteettia osoittavasta, vaiheen 3 tutkimuksesta. Lancet. 2019;393(10167):143-155.
28. Mayer KH, Molina JM, Thompson MA, et al. Emtrisitabiini ja tenofoviirialafenamidi vs. emtrisitabiini ja tenofoviiridisoproksiilifumaraatti HIV:n altistumista edeltävässä profylaksiassa (DISCOVER): ensisijaiset tulokset satunnaistetusta, kaksoissokkoutetusta, aktiivikontrolloidusta, aktiivikontrolloidusta, vaiheen 3 ei-eriarvoisuustutkimuksesta. Lancet. 2020;396(10246):239-254.
29. Hill A, Hughes SL, Gotham D, Pozniak AL. Tenofoviirialafenamidi vs. tenofoviiridisoproksiilifumaraatti: onko tehossa ja turvallisuudessa todellista eroa? J Virus Erad. 2018;4(2):72-79.