La théorie VSEPR est capable d’expliquer et de prédire les formes des molécules qui contiennent des paires solitaires. Dans ce cas, on considère que les paires solitaires ainsi que les paires de liaison se repoussent et s’évitent mutuellement. Par exemple, étant donné qu’il y a deux liaisons dans la molécule SnCl2, on pourrait s’attendre à ce qu’elle soit linéaire comme BeCl2. Pourtant, si l’on trace le diagramme de Lewis, on trouve une paire solitaire ainsi que deux paires de liaison dans la coquille de valence de l’atome de Sn :
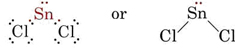_Chloride.jpg?revision=1&size=bestfit&width=235&height=48)
Une paire solitaire affecte également la structure de l’ammoniac, NH3. Comme cette molécule obéit à la règle de l’octuor, l’atome N est entouré de quatre paires d’électrons :
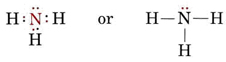
Si ces paires étaient toutes équivalentes, on s’attendrait à ce que l’angle entre elles soit l’angle tétraédrique régulier de 109,5°. Expérimentalement, on constate que l’angle est légèrement inférieur, à savoir 107°. Encore une fois, cela est dû au fait que la paire solitaire est plus « grosse » que les paires de liaison et qu’elle est capable de les serrer plus étroitement.
La structure électronique de la molécule H2O est similaire à celle de NH3, sauf qu’une paire de liaison a été remplacée par une paire solitaire:
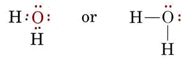
Exemple \(\PageIndex{1}\) : Géométrie moléculaire
Création et description de la géométrie des molécules suivantes : (a) GaCl3, (b) AsCl3, et (c) AsOCl3.
Solution
a) Comme l’élément gallium appartient au groupe III, il possède trois électrons de valence. Le diagramme de Lewis pour GaCl3 est donc
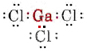
Puisqu’il y a trois paires de liaison et pas de paires solitaires autour de l’atome de Ga, on en conclut que les trois atomes de Cl sont disposés en trigone et que les quatre atomes sont dans le même plan.
b) L’arsenic appartient au groupe V et possède donc cinq électrons de valence. La structure de Lewis pour AsCl3 est donc
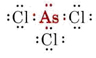
Puisqu’une paire solitaire est présente, la forme de cette molécule est une pyramide trigonale, avec le noyau As un peu au-dessus d’un triangle équilatéral de noyaux Cl.
c) Le diagramme de Lewis de AsOCl3 est similaire à celui de AsCl3.

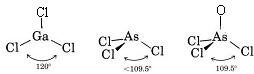
La théorie VSEPR peut également être appliquée aux molécules qui contiennent cinq et six paires d’électrons de valence, dont certaines sont des paires solitaires. Nous n’avons pas inclus de telles espèces ici car la majorité des composés entrent dans les catégories que nous avons décrites.
Contributeurs
-
Ed Vitz (Université de Kutztown), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (Université du Minnesota Rochester), Tim Wendorff et Adam Hahn.
.