Objectifs d’apprentissage
- Identifier les alcanes, les alcènes, les alcynes et les composés aromatiques.
- Lister quelques propriétés des hydrocarbures.
Les composés organiques les plus simples sont ceux composés de seulement deux éléments : le carbone et l’hydrogène. Ces composés sont appelés hydrocarbures. Les hydrocarbures eux-mêmes sont séparés en deux types : les hydrocarbures aliphatiques et les hydrocarbures aromatiques. Les hydrocarbures aliphatiques sont des hydrocarbures basés sur des chaînes d’atomes de carbone. Il existe trois types d’hydrocarbures aliphatiques. Les alcanes sont des hydrocarbures aliphatiques ne comportant que des liaisons covalentes simples. Les alcènes sont des hydrocarbures aliphatiques qui contiennent au moins une double liaison C-C, et les alcynes sont des hydrocarbures aliphatiques qui contiennent une triple liaison C-C. Occasionnellement, on trouve un hydrocarbure aliphatique avec un cycle d’atomes de C ; ces hydrocarbures sont appelés cycloalcanes (ou cycloalcènes ou cycloalkynes).
Les hydrocarbures aromatiques, comme le benzène,sont des systèmes à cycle plat qui contiennent des orbitales p se chevauchant continuellement.Les électrons du cycle benzénique ont des propriétés énergétiques particulières qui donnent au benzène des propriétés physiques et chimiques nettement différentes de celles des alcanes. À l’origine, le terme aromatique était utilisé pour décrire cette classe de composés parce qu’ils étaient particulièrement odorants. Cependant, dans la chimie moderne, le terme aromatique désigne la présence d’un cycle très stable qui confère des propriétés différentes et uniques à une molécule.
Les alcanes les plus simples ont leurs atomes de C liés en une chaîne droite ; ils sont appelés alcanes normaux. Ils sont nommés en fonction du nombre d’atomes de C dans la chaîne. Le plus petit alcane est le méthane :
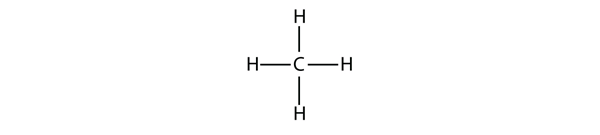
Figure 16.1 Représentation tridimensionnelle du méthane

Pour faire quatre liaisons covalentes, l’atome de C se lie à quatre atomes de H, ce qui donne la formule moléculaire du méthane CH4. Le diagramme bidimensionnel du méthane est cependant trompeur ; les quatre liaisons covalentes que l’atome C établit sont orientées en trois dimensions vers les coins d’un tétraèdre. Une meilleure représentation de la molécule de méthane est illustrée à la figure 16.1 » Représentation tridimensionnelle du méthane « .
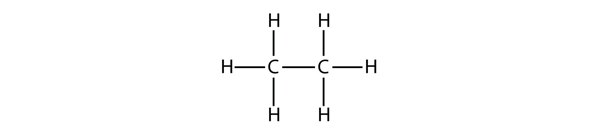
L’alcane le plus grand suivant possède deux atomes de C qui sont liés l’un à l’autre de manière covalente. Pour que chaque atome de C établisse quatre liaisons covalentes, il faut qu’il soit lié à trois atomes d’hydrogène. La molécule résultante, dont la formule est C2H6, est l’éthane:
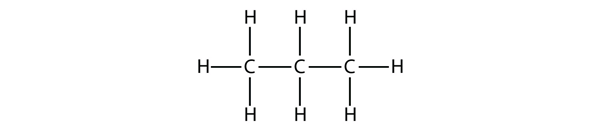
Le propane a un squelette de trois atomes de C entourés d’atomes de H. Vous devriez être capable de vérifier que la formule moléculaire du propane est C3H8:
Les diagrammes que nous avons vus jusqu’à présent représentant les alcanes sont des structures de Lewis assez simples. Cependant, lorsque les molécules deviennent plus grandes, les structures de Lewis deviennent de plus en plus complexes. Une façon de contourner ce problème est d’utiliser une structure condensée,qui liste la formule de chaque atome de C dans le squelette de la molécule. Par exemple, la structure condensée de l’éthane est CH3CH3, alors qu’elle est CH3CH2CH3 pour le propane. Le tableau 16.1 « Les 10 premiers alcanes » donne les formules moléculaires, les formules de structure condensée et les noms des 10 premiers alcanes.
Tableau 16.1 Les 10 premiers alcanes
| Formule moléculaire | Formule structurale condensée | Nom |
|---|---|---|
| CH4 | CH4 | méthane |
| C2H6 | CH3CH3 | éthane |
| C3H8 | CH3CH2CH3 | propane |
| C4H10 | CH3CH2CH2CH3 | butane |
| C5H12 | CH3CH2CH2CH2CH2CH3 | pentane |
| C6H14 | CH3(CH2)4CH3 | hexane |
| C7H16 | CH3(CH2)5CH3 | heptane |
| C8H18 | CH3(CH2)6CH3 | octane |
| C9H20 | CH3(CH2)7CH3 | nonane |
| C10H22 | CH3(CH2)8CH3 | décane |
Parce que les alcanes possèdent le maximum d’atomes H possible selon les règles des liaisons covalentes, les alcanes sont aussi appelés des hydrocarbures saturés.
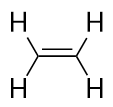
Les alcènes possèdent une double liaison C-C. Parce qu’ils ont moins que le nombre maximum d’atomes H possible, ils sont appelés hydrocarbures insaturés. Le plus petit alcène – l’éthène – possède deux atomes de carbone et est également connu sous son nom commun, l’éthylène :
Le plus grand alcène suivant – le propène – possède trois atomes de carbone avec une double liaison C-C entre deux des atomes de carbone. Il est également connu sous le nom de propylène :
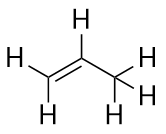
Que remarquez-vous sur les noms des alcanes et des alcènes ? Les noms des alcènes sont les mêmes que ceux des alcanes correspondants, sauf que le suffixe (terminaison) est -ène, plutôt que -ane. L’utilisation d’une tige appelée chaîne parentale pour indiquer le nombre d’atomes de C dans une molécule et d’une terminaison pour représenter le type de composé organique est courante en chimie organique, comme nous le verrons.
Avec l’introduction de l’alcène suivant, le butène, nous commençons à voir un problème majeur avec les molécules organiques : les choix. Avec quatre atomes de C, la double liaison C-C peut aller entre le premier et le deuxième atome de C ou entre le deuxième et le troisième atome de C :
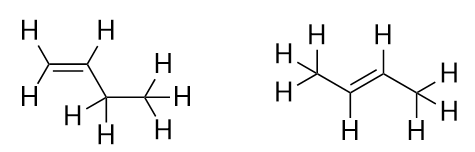
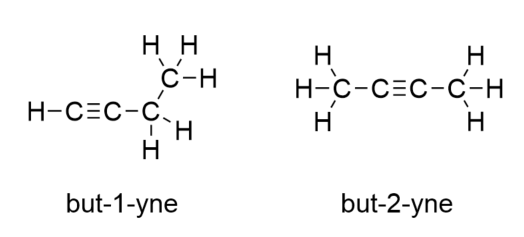
(Une double liaison entre le troisième et le quatrième atome de C est la même chose que de l’avoir entre le premier et le deuxième atome de C, seulement inversée). Les règles de dénomination en chimie organique exigent que ces deux substances portent des noms différents. La première molécule est nommée but-1-ène, tandis que la deuxième molécule est nommée but-2-ène. Le nombre situé entre le nom de la chaîne parentale et le suffixe est appelé locus, et indique sur quel carbone la double liaison se trouve. Le nombre le plus bas possible est utilisé pour numéroter une caractéristique d’une molécule ; par conséquent, il serait incorrect d’appeler la deuxième molécule but-3-ène. Les nombres sont des éléments courants des noms chimiques organiques car ils indiquent quel atome de carbone d’une chaîne contient un élément distinctif. Lorsque la double liaison (ou un autre groupe fonctionnel) est située sur le premier atome de carbone, il est courant pour certains auteurs d’omettre le locatif. Par exemple, si le butène était écrit sans locution, vous devriez supposer qu’il s’agit du but-1-ène et non du but-2-ène.
Les composés but-1-ène et but-2-ène ont des propriétés physiques et chimiques différentes, même s’ils ont la même formule moléculaire-C4H8. Des molécules différentes ayant la même formule moléculaire sont appelées isomères. Les isomères sont courants en chimie organique et contribuent à sa complexité.
Exemple 1
Sur la base des noms des molécules de butène, proposez un nom pour cette molécule.
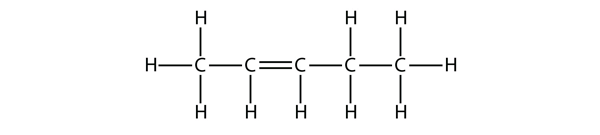
Solution
Avec cinq atomes de C, nous utiliserons le nom pent- parent, et avec une double liaison C-C, c’est un alcène, donc cette molécule est un pentène. Dans la numérotation des atomes de C, nous utilisons le chiffre 2 car c’est l’étiquette inférieure possible. Donc cette molécule est nommée pent-2-ène.
Testez vous-même
En vous basant sur les noms des molécules de butène, proposez un nom pour cette molécule.
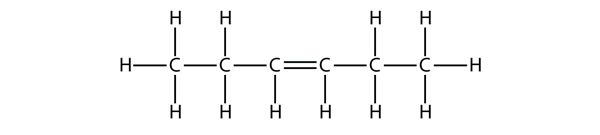
Réponse
hex-3-ène
Les alcynes, avec une triple liaison C-C, sont nommés de la même façon que les alcènes sauf que leurs noms se terminent en -yne. Le plus petit alcyne est l’éthyne, qui est également connu sous le nom d’acétylène :
![]()
Propyne a cette structure :
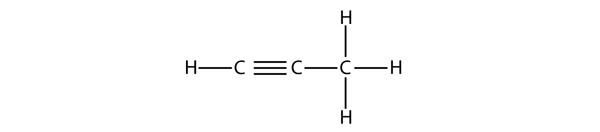
Avec le butyne, nous devons commencer à numéroter la position de la triple liaison, comme nous l’avons fait avec les alcènes :
Le benzène est un composé aromatique composé de six atomes de C dans un cycle, avec une alternance de liaisons C-C simples et doubles :
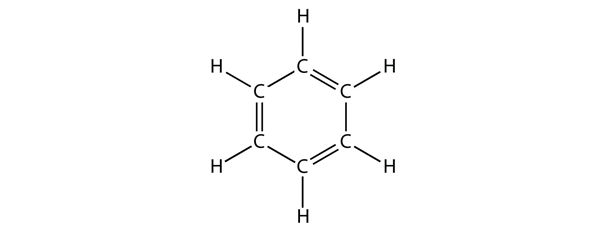
L’alternance de liaisons C-C simples et doubles donne au cycle benzénique une stabilité particulière, et il ne réagit pas comme un alcène comme on pourrait s’y attendre.
Aussi fondamentaux que soient les hydrocarbures pour la chimie organique, leurs propriétés et leurs réactions chimiques sont plutôt banales. La plupart des hydrocarbures sont non polaires en raison de la proximité des électronégativités des atomes de C et de H. Ils ne se dissolvent qu’en présence d’un solvant. En tant que tels, ils ne se dissolvent qu’avec parcimonie dans H2O et d’autres solvants polaires. Les petits hydrocarbures, comme le méthane et l’éthane, sont des gaz à température ambiante, tandis que les hydrocarbures plus gros, comme l’hexane et l’octane, sont des liquides. Les hydrocarbures encore plus grands, comme l’hentriacontane (C31H64), sont des solides à température ambiante et ont une consistance molle et cireuse.
Les hydrocarbures sont plutôt peu réactifs, mais ils participent à certaines réactions chimiques classiques. Une réaction courante est la substitution par un atome d’halogène en combinant un hydrocarbure avec un halogène élémentaire. La lumière est parfois utilisée pour favoriser la réaction, comme celle-ci entre le méthane et le chlore:
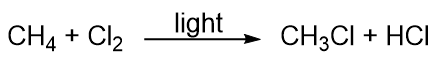
Les halogènes peuvent également réagir avec les alcènes et les alcynes, mais la réaction est différente. Dans ces cas, les molécules d’halogène réagissent avec la double ou triple liaison C-C et se fixent sur chaque atome de C impliqué dans les liaisons multiples. Cette réaction est appelée réaction d’addition. Un exemple est
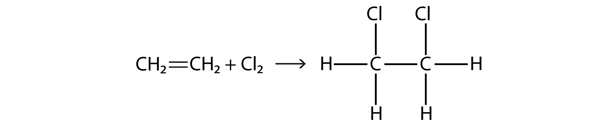
Les conditions de réaction sont généralement douces ; dans de nombreux cas, l’halogène réagit spontanément avec un alcène ou un alcyne.
L’hydrogène peut également être ajouté à travers une liaison multiple ; cette réaction est appelée réaction d’hydrogénation. Dans ce cas, cependant, les conditions de réaction peuvent ne pas être douces ; des pressions élevées de gaz H2 peuvent être nécessaires. Un catalyseur à base de platine ou de palladium est généralement employé pour que la réaction se déroule à un rythme raisonnable:
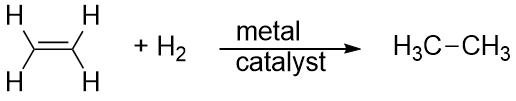
De loin, la réaction la plus courante des hydrocarbures est la combustion, qui est la combinaison d’un hydrocarbure avec O2 pour produire du CO2 et du H2O. La combustion des hydrocarbures s’accompagne d’un dégagement d’énergie et constitue une source primaire de production d’énergie dans notre société (figure 16.2 « Combustion »). La réaction de combustion de l’essence, par exemple, qui peut être représentée par C8H18, est la suivante :
2 C8H18 + 25 O2 → 16 CO2 + 18 H2O + ~5060 kJ
Figure 16.2 Combustion

.