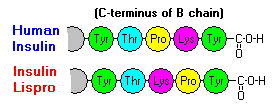VIVO patofiziológia
Az inzulin szerkezete
Az inzulin két peptidláncból, az úgynevezett A- és B-láncból áll. Az A- és a B-láncot két diszulfidkötés köti össze, és egy további diszulfid képződik az A-láncon belül. A legtöbb fajban az A-lánc 21 aminosavból, a B-lánc pedig 30 aminosavból áll.
Bár az inzulin aminosavsorrendje fajonként változik, a molekula bizonyos szegmensei erősen konzerváltak, beleértve a három diszulfidkötés helyzetét, az A-lánc mindkét végét és a B-lánc C-terminális maradékát. Az inzulin aminosav-szekvenciájának e hasonlóságai az inzulin háromdimenziós konformációjához vezetnek, amely nagyon hasonló a fajok között, és az egyik állatból származó inzulin nagy valószínűséggel biológiailag aktív más fajokban. Valóban, a sertésinzulint széles körben használják emberi betegek kezelésére.
Az inzulinmolekulák a B-láncok C-terminálisai közötti hidrogénkötés miatt oldatban hajlamosak dimereket képezni. Ezenkívül cinkionok jelenlétében az inzulin dimerek hexamerekké társulnak.
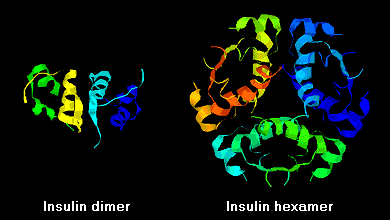
Ezeknek a kölcsönhatásoknak fontos klinikai következményei vannak. A monomerek és dimerek könnyen diffundálnak a vérbe, míg a hexamerek rosszul diffundálnak. Ezért a nagy arányban hexamereket tartalmazó inzulinkészítmények felszívódása késleltetett és kissé lassú. Többek között ez a jelenség ösztönözte számos rekombináns inzulin analóg kifejlesztését. Ezen molekulák közül az elsőt, amelyet forgalomba hoztak – az inzulin lispro-t – úgy alakították ki, hogy a B-lánc C-terminális végén lévő lizin- és prolin-maradékokat felcserélték; ez a módosítás nem változtatja meg a receptorkötődést, de minimalizálja a dimerek és hexamerek kialakulására való hajlamot.