Objetivos de aprendizaje
- Identificar los alcanos, alquenos, alquinos y compuestos aromáticos.
- Enumerar algunas propiedades de los hidrocarburos.
Los compuestos orgánicos más sencillos son los formados por sólo dos elementos: carbono e hidrógeno. Estos compuestos se denominan hidrocarburos. Los hidrocarburos se dividen en dos tipos: hidrocarburos alifáticos e hidrocarburos aromáticos. Los hidrocarburos alifáticos son hidrocarburos basados en cadenas de átomos de C. Hay tres tipos de hidrocarburos alifáticos. Los alcanos son hidrocarburos alifáticos con un solo enlace covalente. Los alquenos son hidrocarburos alifáticos que contienen al menos un doble enlace C-C, y los alquinos son hidrocarburos alifáticos que contienen un triple enlace C-C. Ocasionalmente, encontramos un hidrocarburo alifático con un anillo de átomos de C; estos hidrocarburos se denominan cicloalcanos (o cicloalquenos o cicloalquinos).
Los hidrocarburos aromáticos, como el benceno, son sistemas de anillos planos que contienen orbitales p continuamente superpuestos.Los electrones del anillo de benceno tienen propiedades energéticas especiales que dan al benceno propiedades físicas y químicas que son marcadamente diferentes de las de los alcanos. Originalmente, el término aromático se utilizaba para describir esta clase de compuestos porque eran particularmente fragantes. Sin embargo, en la química moderna el término aromático denota la presencia de un anillo muy estable que imparte propiedades diferentes y únicas a una molécula.
Los alcanos más simples tienen sus átomos de C unidos en una cadena recta; éstos se llaman alcanos normales. Se denominan según el número de átomos de C en la cadena. El alcano más pequeño es el metano:
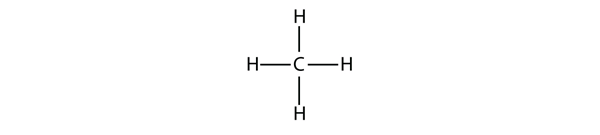
Figura 16.1 Representación tridimensional del metano

Para hacer cuatro enlaces covalentes, el átomo de C se une a cuatro átomos de H, haciendo la fórmula molecular del metano CH4. Sin embargo, el diagrama bidimensional del metano es engañoso; los cuatro enlaces covalentes que realiza el átomo de C están orientados tridimensionalmente hacia las esquinas de un tetraedro. Una mejor representación de la molécula de metano se muestra en la Figura 16.1 «Representación tridimensional del metano»
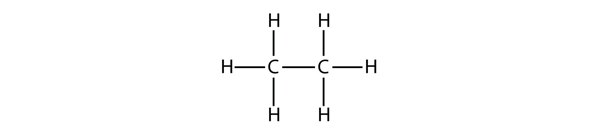
El siguiente alcano más grande tiene dos átomos de C que están unidos covalentemente entre sí. Para que cada átomo de C forme cuatro enlaces covalentes, cada átomo de C debe estar unido a tres átomos de H. La molécula resultante, cuya fórmula es C2H6, es el etano:
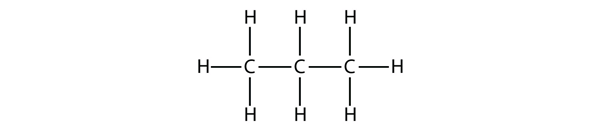
El propano tiene una columna vertebral de tres átomos de C rodeados de átomos de H. Deberías poder comprobar que la fórmula molecular del propano es C3H8:
Los diagramas que hemos visto hasta ahora representando alcanos son estructuras de Lewis bastante sencillas. Sin embargo, a medida que las moléculas se hacen más grandes, las estructuras de Lewis se vuelven más y más complejas. Una forma de evitar esto es utilizar una estructura condensada, que enumera la fórmula de cada átomo de C en la columna vertebral de la molécula. Por ejemplo, la estructura condensada para el etano es CH3CH3, mientras que para el propano es CH3CH2CH3. La tabla 16.1 «Los 10 primeros alcanos» da las fórmulas moleculares, las fórmulas estructurales condensadas y los nombres de los 10 primeros alcanos.
Tabla 16.1 Los 10 primeros alcanos
| Fórmula molecular | Fórmula estructural condensada | Nombre |
|---|---|---|
| CH4 | CH4 | metano |
| C2H6 | CH3CH3 | etano |
| C3H8 | CH3CH3 | propano |
| C4H10 | CH3CH2CH3 | butano |
| C5H12 | CH3CH2CH2CH2CH3 | pentano |
| C6H14 | CH3(CH2)4CH3 | hexano |
| C7H16 | CH3(CH2)5CH3 | heptano |
| C8H18 | CH3(CH2)6CH3 | octano |
| C9H20 | CH3(CH2)7CH3 | nonano |
| C10H22 | CH3(CH2)8CH3 | decano |
Porque los alcanos tienen el máximo número de átomos de H posible según las reglas de los enlaces covalentes, los alcanos también se denominan hidrocarburos saturados.
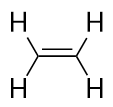
Los alquenos tienen un doble enlace C-C. Como tienen menos del número máximo de átomos de H posible, se denominan hidrocarburos insaturados. El alqueno más pequeño -el eteno- tiene dos átomos de C y también se conoce por su nombre común, etileno:
El siguiente alqueno más grande -el propeno- tiene tres átomos de C con un doble enlace C-C entre dos de los átomos de C. También se conoce como propileno:
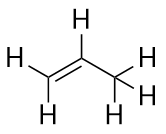
¿Qué notas sobre los nombres de los alcanos y los alquenos? Los nombres de los alquenos son los mismos que los de sus correspondientes alcanos, salvo que el sufijo (terminación) es -ene, en lugar de -ane. El uso de una raíz conocida como cadena madre para indicar el número de átomos de C en una molécula y una terminación para representar el tipo de compuesto orgánico es común en la química orgánica, como veremos.
Con la introducción del siguiente alqueno, el buteno, empezamos a ver un problema importante con las moléculas orgánicas: las opciones. Con cuatro átomos de C, el doble enlace C-C puede ir entre el primer y el segundo átomo de C o entre el segundo y el tercer átomo de C:
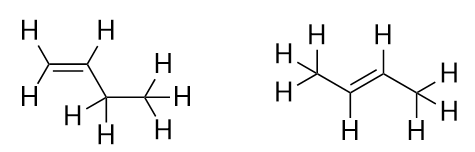
(Un doble enlace entre el tercer y el cuarto átomo de C es lo mismo que tenerlo entre el primer y el segundo átomo de C, sólo que volteado). Las reglas de denominación de la química orgánica exigen que estas dos sustancias tengan nombres diferentes. La primera molécula se llama but-1-eno, mientras que la segunda se llama but-2-eno. El número entre el nombre de la cadena madre y el sufijo se conoce como locante, e indica en qué carbono se origina el doble enlace. El número más bajo posible se utiliza para numerar una característica en una molécula; por lo tanto, llamar a la segunda molécula but-3-ene sería incorrecto. Los números son partes comunes de los nombres químicos orgánicos porque indican qué átomo de C en una cadena contiene una característica distintiva. Cuando el doble enlace (u otro grupo funcional) se encuentra en el primer carbono, es una práctica común para algunos autores omitir el locante. Por ejemplo, si el buteno se escribiera sin locante, se debería asumir que se refiere al but-1-eno, no al but-2-eno.
Los compuestos but-1-eno y but-2-eno tienen propiedades físicas y químicas diferentes, aunque tengan la misma fórmula molecular-C4H8. Las moléculas diferentes con la misma fórmula molecular se llaman isómeros. Los isómeros son comunes en la química orgánica y contribuyen a su complejidad.
Ejemplo 1
A partir de los nombres de las moléculas de buteno, proponga un nombre para esta molécula.
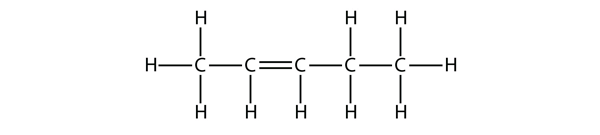
Solución
Con cinco átomos de C, utilizaremos el nombre de penteno, y con un doble enlace C-C, se trata de un alqueno, por lo que esta molécula es un penteno. Al numerar los átomos de C, utilizamos el número 2 porque es la etiqueta más baja posible. Así que esta molécula se llama pent-2-eno.
Ponte a prueba
Basándote en los nombres de las moléculas de buteno, propón un nombre para esta molécula.
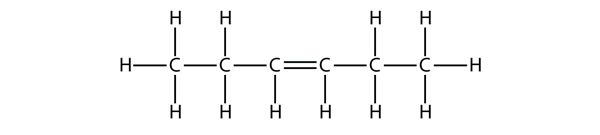
Responde
hex-3-ene
Los alquinos, con un triple enlace C-C, se denominan de forma similar a los alquenos, excepto que sus nombres terminan en -yne. El alquino más pequeño es el eteno, que también se conoce como acetileno:
![]()
El propino tiene esta estructura:
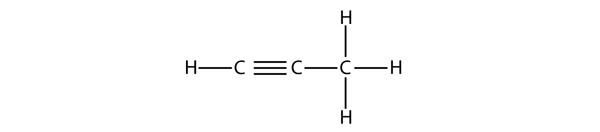
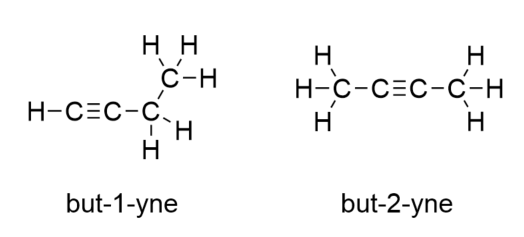
En el caso del butino, tenemos que empezar a numerar la posición del triple enlace, igual que hicimos con los alquenos:
El benceno es un compuesto aromático formado por seis átomos de C en un anillo, con enlaces C-C sencillos y dobles alternados:
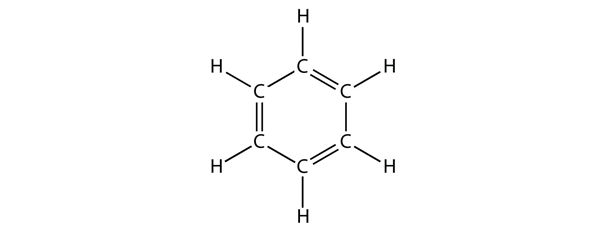
Los enlaces C-C sencillos y dobles alternados dan al anillo de benceno una estabilidad especial, y no reacciona como un alqueno como cabría esperar.
A pesar de que los hidrocarburos son fundamentales para la química orgánica, sus propiedades y reacciones químicas son más bien mundanas. La mayoría de los hidrocarburos no son polares debido a la proximidad de las electronegatividades de los átomos de C y H. Por lo tanto, sólo se disuelven de forma dispersa. Por ello, se disuelven muy poco en H2O y otros disolventes polares. Los hidrocarburos pequeños, como el metano y el etano, son gases a temperatura ambiente, mientras que los más grandes, como el hexano y el octano, son líquidos. Incluso los hidrocarburos más grandes, como el hentriacontano (C31H64), son sólidos a temperatura ambiente y tienen una consistencia blanda y cerosa.
Los hidrocarburos son bastante poco reactivos, pero participan en algunas reacciones químicas clásicas. Una reacción común es la sustitución con un átomo de halógeno mediante la combinación de un hidrocarburo con un halógeno elemental. A veces se utiliza la luz para promover la reacción, como ésta entre el metano y el cloro:
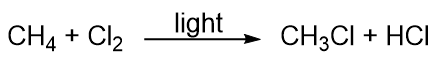
Los halógenos también pueden reaccionar con alquenos y alquinos, pero la reacción es diferente. En estos casos, las moléculas de halógeno reaccionan con el doble o triple enlace C-C y se adhieren a cada átomo de C involucrado en los enlaces múltiples. Esta reacción se denomina reacción de adición. Un ejemplo es
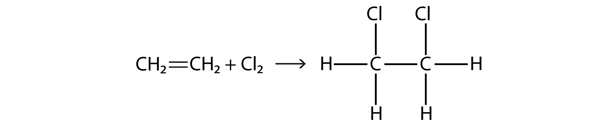
Las condiciones de reacción suelen ser suaves; en muchos casos, el halógeno reacciona espontáneamente con un alqueno o un alquino.
El hidrógeno también puede añadirse a través de un enlace múltiple; esta reacción se denomina reacción de hidrogenación. En este caso, sin embargo, las condiciones de reacción pueden no ser suaves; pueden ser necesarias altas presiones de gas H2. Se suele emplear un catalizador de platino o paladio para conseguir que la reacción proceda a un ritmo razonable:
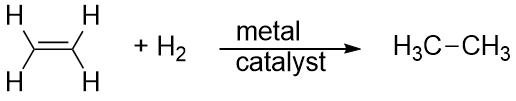
La reacción más común de los hidrocarburos es, con mucho, la combustión, que es la combinación de un hidrocarburo con O2 para hacer CO2 y H2O. La combustión de los hidrocarburos va acompañada de una liberación de energía y es una fuente primaria de producción de energía en nuestra sociedad (Figura 16.2 «Combustión»). La reacción de combustión de la gasolina, por ejemplo, que puede representarse con C8H18, es la siguiente:
2 C8H18 + 25 O2 → 16 CO2 + 18 H2O + ~5060 kJ
Figura 16.2 Combustión
