Obiettivi di apprendimento
- Identificare alcani, alcheni, alchini e composti aromatici.
- Elenca alcune proprietà degli idrocarburi.
I composti organici più semplici sono quelli composti da due soli elementi: carbonio e idrogeno. Questi composti sono chiamati idrocarburi. Gli idrocarburi stessi sono separati in due tipi: idrocarburi alifatici e idrocarburi aromatici. Gli idrocarburi alifatici sono idrocarburi basati su catene di atomi di C. Ci sono tre tipi di idrocarburi alifatici. Gli alcani sono idrocarburi alifatici con un solo legame covalente. Gli alcheni sono idrocarburi alifatici che contengono almeno un doppio legame C-C, e gli alchini sono idrocarburi alifatici che contengono un triplo legame C-C. Occasionalmente, troviamo un idrocarburo alifatico con un anello di atomi C; questi idrocarburi sono chiamati cicloalcani (o cicloalceni o cicloalcini).
Gli idrocarburi aromatici, come il benzene, sono sistemi ad anello piatto che contengono orbitali p continuamente sovrapposti.Gli elettroni nell’anello del benzene hanno speciali proprietà energetiche che danno al benzene proprietà fisiche e chimiche che sono notevolmente diverse dagli alcani. Originariamente, il termine aromatico era usato per descrivere questa classe di composti perché erano particolarmente fragranti. Tuttavia, nella chimica moderna il termine aromatico denota la presenza di un anello molto stabile che conferisce proprietà diverse e uniche a una molecola.
Gli alcani più semplici hanno i loro atomi di C legati in una catena dritta; questi sono chiamati alcani normali. Sono nominati secondo il numero di atomi di C nella catena. Il più piccolo alcano è il metano:
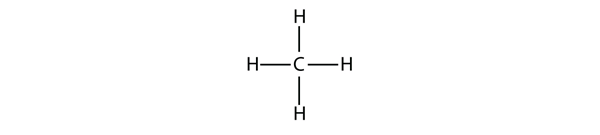
Figura 16.1 Rappresentazione tridimensionale del metano

Per fare quattro legami covalenti, l’atomo C si lega a quattro atomi H, rendendo la formula molecolare del metano CH4. Il diagramma bidimensionale del metano è tuttavia fuorviante; i quattro legami covalenti che l’atomo di C crea sono orientati tridimensionalmente verso gli angoli di un tetraedro. Una migliore rappresentazione della molecola del metano è mostrata nella figura 16.1 “Rappresentazione tridimensionale del metano”.
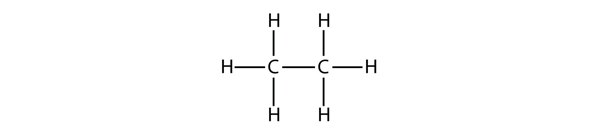
L’alcano successivo più grande ha due atomi di C che sono legati covalentemente tra loro. Affinché ogni atomo di C faccia quattro legami covalenti, ogni atomo di C deve essere legato a tre atomi di H. La molecola risultante, la cui formula è C2H6, è etano:
Il propano ha una spina dorsale di tre atomi di C circondati da atomi di H. Dovresti essere in grado di verificare che la formula molecolare del propano è C3H8:
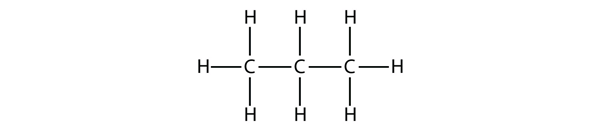
I diagrammi che abbiamo visto finora che rappresentano gli alcani sono strutture di Lewis abbastanza semplici. Tuttavia, quando le molecole diventano più grandi, le strutture di Lewis diventano sempre più complesse. Un modo per aggirare questo problema è usare una struttura condensata, che elenca la formula di ogni atomo di C nella spina dorsale della molecola. Per esempio, la struttura condensata per l’etano è CH3CH3, mentre è CH3CH2CH3 per il propano. La tabella 16.1 “I primi 10 alcani” fornisce le formule molecolari, le formule strutturali condensate e i nomi dei primi 10 alcani.
Tabella 16.1 I primi 10 alcani
| Formula molecolare | Formula strutturale condensata | Nome |
|---|---|---|
| CH4 | CH4 | metano |
| C2H6 | CH3CH3 | etano |
| C3H8 | CH3CH2CH3 | propano |
| C4H10 | CH3CH2CH2CH3 | butano |
| C5H12 | CH3CH2CH2CH2CH2CH3 | pentano |
| C6H14 | CH3(CH2)4CH3 | esano |
| C7H16 | CH3(CH2)5CH3 | eptano |
| C8H18 | CH3(CH2)6CH3 | ottano |
| C9H20 | CH3(CH2)7CH3 | nonano |
| C10H22 | CH3(CH2)8CH3 | decano |
Perché gli alcani hanno il massimo numero di atomi H possibile secondo le regole dei legami covalenti, gli alcani sono anche chiamati idrocarburi saturi.
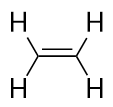
Gli alcheni hanno un doppio legame C-C. Poiché hanno meno del numero massimo possibile di atomi H, sono chiamati idrocarburi insaturi. L’alchene più piccolo, l’etene, ha due atomi di C ed è conosciuto anche con il suo nome comune, etilene:
L’alchene successivo più grande, il propene, ha tre atomi di C con un doppio legame C-C tra due degli atomi di C. È anche conosciuto come propilene:
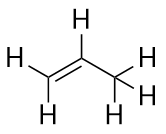
Cosa noti sui nomi degli alcani e degli alcheni? I nomi degli alcheni sono gli stessi dei loro corrispondenti alcani, tranne che il suffisso (finale) è -ene, piuttosto che -ane. Usare uno stelo noto come catena madre per indicare il numero di atomi di C in una molecola e un finale per rappresentare il tipo di composto organico è comune in chimica organica, come vedremo.
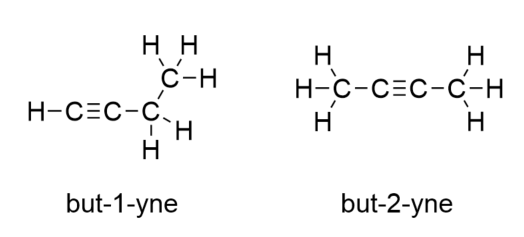
Con l’introduzione del prossimo alchene, il butene, cominciamo a vedere un grande problema con le molecole organiche: le scelte. Con quattro atomi di C, il doppio legame C-C può andare tra il primo e il secondo atomo di C o tra il secondo e il terzo atomo di C:
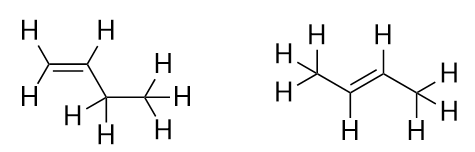
(Un doppio legame tra il terzo e il quarto atomo di C è come averlo tra il primo e il secondo atomo di C, solo capovolto). Le regole di denominazione in chimica organica richiedono che queste due sostanze abbiano nomi diversi. La prima molecola si chiama but-1-ene, mentre la seconda molecola si chiama but-2-ene. Il numero tra il nome della catena madre e il suffisso è noto come locante, e indica su quale carbonio ha origine il doppio legame. Il numero più basso possibile è usato per numerare una caratteristica in una molecola; quindi, chiamare la seconda molecola but-3-ene sarebbe scorretto. I numeri sono parti comuni dei nomi chimici organici perché indicano quale atomo di C in una catena contiene una caratteristica distintiva. Quando il doppio legame (o altro gruppo funzionale) si trova sul primo carbonio, è pratica comune per alcuni autori lasciare fuori la locante. Per esempio, se il butene fosse scritto senza una locante, si dovrebbe assumere che si riferisce al but-1-ene, non al but-2-ene.
I composti but-1-ene e but-2-ene hanno diverse proprietà fisiche e chimiche, anche se hanno la stessa formula molecolare-C4H8. Molecole diverse con la stessa formula molecolare sono chiamate isomeri. Gli isomeri sono comuni nella chimica organica e contribuiscono alla sua complessità.
Esempio 1
In base ai nomi delle molecole di butene, proponi un nome per questa molecola.
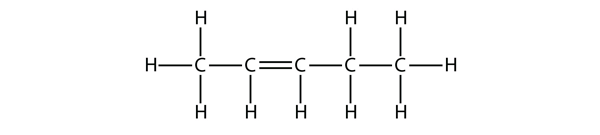
Soluzione
Con cinque atomi di C, useremo il nome di pentapartner, e con un doppio legame C-C, questo è un alchene, quindi questa molecola è un pentene. Nel numerare gli atomi di C, usiamo il numero 2 perché è la più bassa etichetta possibile. Quindi questa molecola si chiama pent-2-ene.
Test Yourself
In base ai nomi delle molecole di butene, proponi un nome per questa molecola.
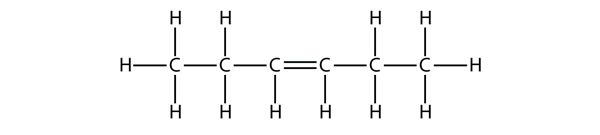
Rispondi
hex-3-ene
Gli alchini, con un triplo legame C-C, sono chiamati in modo simile agli alcheni, tranne che il loro nome finisce in -yne. Il più piccolo alchene è l’etilene, che è anche conosciuto come acetilene:
![]()
Il propirene ha questa struttura:
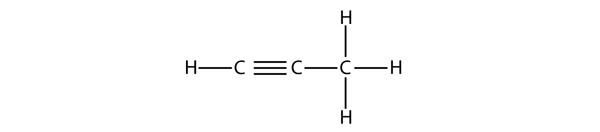
Con il butine, dobbiamo iniziare a numerare la posizione del triplo legame, proprio come abbiamo fatto con gli alcheni:
Il benzene è un composto aromatico composto da sei atomi di C in un anello, con alternanza di legami C-C singoli e doppi:
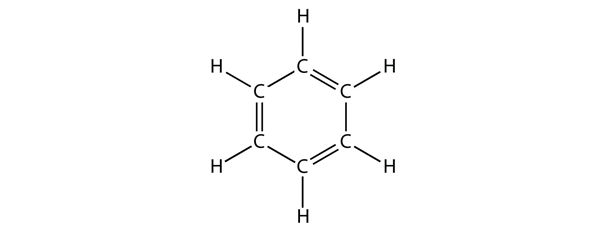
L’alternanza di legami C-C singoli e doppi dà all’anello del benzene una stabilità speciale, e non reagisce come un alchene come ci si potrebbe aspettare.
Per quanto gli idrocarburi siano fondamentali per la chimica organica, le loro proprietà e reazioni chimiche sono piuttosto banali. La maggior parte degli idrocarburi sono non polari a causa della stretta elettronegatività degli atomi C e H. Come tali, si dissolvono solo con parsimonia in H2O e altri solventi polari. I piccoli idrocarburi, come il metano e l’etano, sono gas a temperatura ambiente, mentre gli idrocarburi più grandi, come l’esano e l’ottano, sono liquidi. Anche gli idrocarburi più grandi, come l’hentriacontano (C31H64), sono solidi a temperatura ambiente e hanno una consistenza morbida e cerosa.
Gli idrocarburi sono piuttosto poco reattivi, ma partecipano ad alcune reazioni chimiche classiche. Una reazione comune è la sostituzione con un atomo di alogeno combinando un idrocarburo con un alogeno elementare. La luce è talvolta usata per promuovere la reazione, come questa tra metano e cloro:
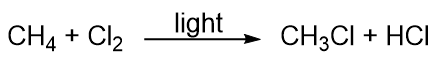
Gli alogeni possono anche reagire con alcheni e alchini, ma la reazione è diversa. In questi casi, le molecole alogene reagiscono con il doppio o triplo legame C-C e si attaccano ad ogni atomo di C coinvolto nei legami multipli. Questa reazione è chiamata reazione di addizione. Un esempio è
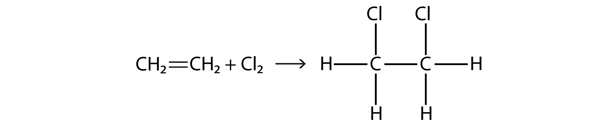
Le condizioni di reazione sono solitamente blande; in molti casi, l’alogeno reagisce spontaneamente con un alchene o un alchene.
L’idrogeno può anche essere aggiunto attraverso un legame multiplo; questa reazione è chiamata reazione di idrogenazione. In questo caso, tuttavia, le condizioni di reazione possono non essere miti; possono essere necessarie alte pressioni di gas H2. Un catalizzatore di platino o palladio è solitamente impiegato per far procedere la reazione a un ritmo ragionevole:
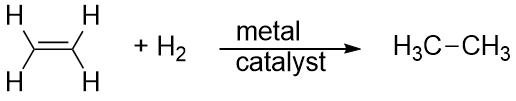
La reazione di gran lunga più comune degli idrocarburi è la combustione, che è la combinazione di un idrocarburo con O2 per fare CO2 e H2O. La combustione degli idrocarburi è accompagnata da un rilascio di energia ed è una fonte primaria di produzione di energia nella nostra società (Figura 16.2 “Combustione”). La reazione di combustione della benzina, per esempio, che può essere rappresentata da C8H18, è la seguente:
2 C8H18 + 25 O2 → 16 CO2 + 18 H2O + ~5060 kJ
Figura 16.2 Combustione
