ABSTRACT: I farmaci antiretrovirali (ARV) disponibili per il trattamento dell’HIV sono aumentati dal 2018. Sono stati approvati nuovi tipi di ARV con nuovi meccanismi d’azione, tra cui ibalizumab-uiyk e fostemsavir. Ci sono state anche approvazioni di compresse di combinazione di farmaci precedentemente disponibili, come bictegravir/emtricitabina/tenofovir alafenamide e dolutegravir/lamivudina. Infine, c’è stata un’espansione delle indicazioni approvate per gli stessi ARV precedentemente disponibili, come emtricitabina/tenofovir alafenamide per l’uso nella profilassi pre-esposizione.
US Pharm. 2020:45(10):17-25.
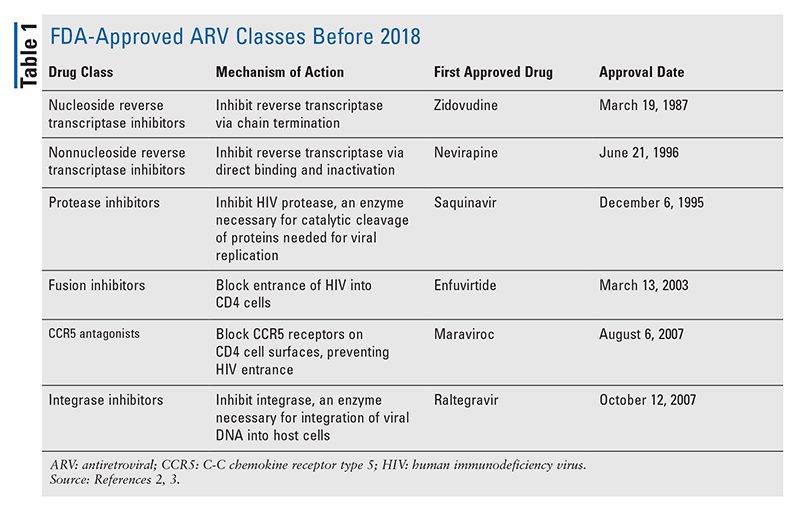
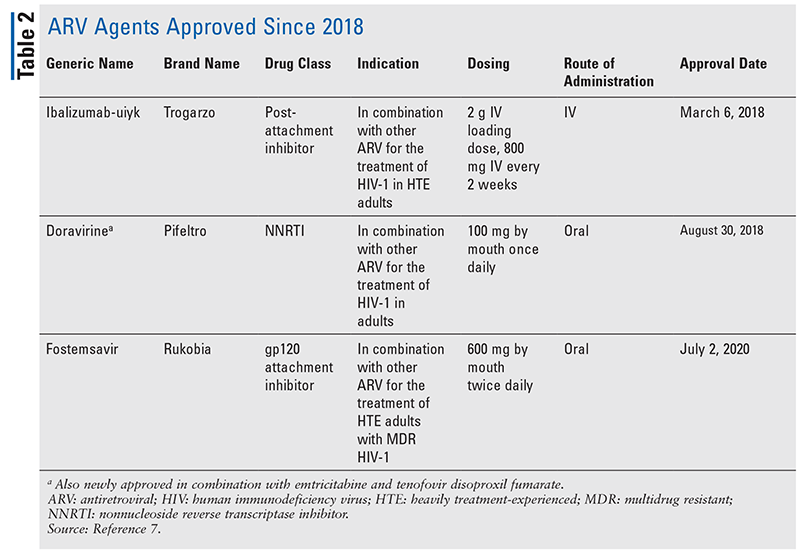
I pilastri degli agenti antiretrovirali (ARV) per il trattamento dell’HIV sono stati in gran parte costituiti dalla stessa manciata di classi di farmaci per anni. Il trattamento dell’HIV è stato inizialmente tentato con gli inibitori nucleosidici della trascrittasi inversa (NRTI), la prima classe di ARV approvata dalla FDA. Gradualmente, sempre più classi sono state scoperte e rese disponibili per il trattamento in vari regimi, spesso complessi (TABELLA 1).1-3 Dopo l’approvazione di raltegravir nel 2007, le nuove approvazioni di farmaci per l’HIV sono state in gran parte per i farmaci disponibili riproposti e i nuovi farmaci di combinazione. Questo è cambiato nel 2018 con l’approvazione di ibalizumab-uiyk, il primo nuovo ARV in oltre un decennio.4 Ibalizumab-uiyk è stato rapidamente seguito da un nuovo inibitore non nucleosidico della trascrittasi inversa (NNRTI), doravirina, più tardi nello stesso anno e da un nuovo inibitore dell’attacco, fostemsavir, nel 2020 (TABELLA 2).5-7
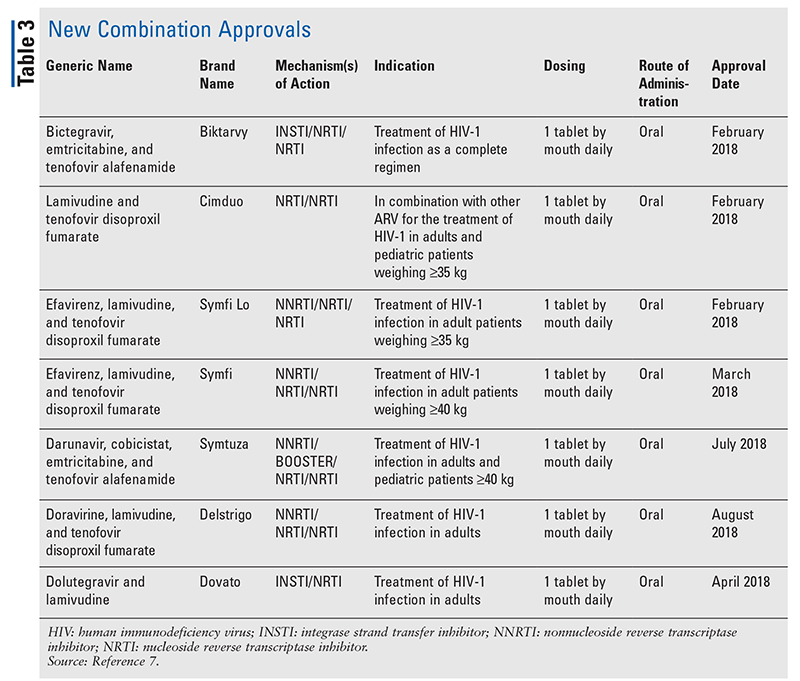
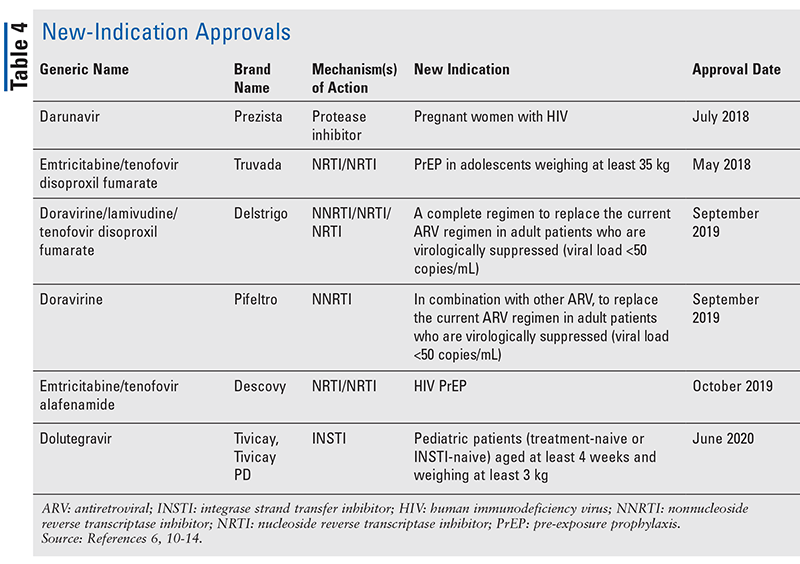
Mentre i nuovi farmaci sono spesso le approvazioni più interessanti, gli ARV sono migliorati in altri modi. Dato l’enorme carico di pillole di molti regimi HIV, gli ARV di combinazione recentemente approvati (TABELLA 3) possono rendere la vita molto più facile ai pazienti. L’uso di tali agenti e la limitazione del carico di pillole necessario hanno dimostrato una migliore aderenza e risultati complessivi.8,9 Ci sono state anche espansioni nelle indicazioni approvate per gli ARV precedentemente disponibili (TABELLA 4), offrendo nuove opzioni per alcune popolazioni di pazienti e indicazioni.10-14
Anche se ci sono molte nuove approvazioni dal 2018, questo articolo presenta quattro dei nuovi farmaci approvati e una nuova indicazione. Queste approvazioni sono state selezionate per dimostrare un campione dell’ampia varietà di nuovi agenti che diventano disponibili, oltre a sottolineare alcune nuove opzioni che offrono un’opportunità unica nel trattamento dell’HIV.
Ibalizumab-Uiyk (Trogarzo)
Ibalizumab-uiyk è un anticorpo monoclonale ricombinante iniettabile che si lega alle proteine di superficie delle cellule CD4 portando a cambiamenti conformazionali che impediscono le fasi post-attacco necessarie alla fusione e all’ingresso dell’HIV-1 nella cellula. È l’unico farmaco monoclonale usato nel trattamento dell’HIV. A causa della sua specificità di legame unica, ibalizumab-uiyk blocca l’entrata virale senza causare immunosoppressione, una preoccupazione in molti farmaci monoclonali.4,15 È indicato in combinazione con altri ARV per il trattamento in adulti pesantemente esitati al trattamento (HTE) con HIV-1 resistente a più farmaci (MDR) che stanno fallendo il loro attuale regime di terapia ARV.4
L’approvazione di ibalizumab-uiyk si è basata su uno studio condotto su 40 pazienti HIV HTE con carica virale superiore a 1.000 copie/mL e una resistenza documentata ad almeno un NRTI, NNRTI e un inibitore della proteasi. I pazienti dovevano anche avere almeno 6 mesi di trattamento e aver fallito la terapia di recente. Lo studio comprendeva tre periodi, iniziando con un periodo di 6 giorni in cui è stata stabilita e confermata la carica virale di base (periodo di controllo). Il giorno 7, i pazienti hanno ricevuto una dose di carico di 2.000 mg di ibalizumab-uiyk in aggiunta al loro regime ART standard (periodo di monoterapia funzionale). Al 14° giorno, la carica virale è stata rivalutata e i regimi sono stati monitorati e regolati per garantire un’attività adeguata contro la loro infezione da HIV. Ibalizumab-uiyk 800 mg è stato somministrato per via endovenosa ogni 2 settimane fino alla conclusione dello studio (periodo di mantenimento). L’endpoint primario ha valutato la differenza nella percentuale di diminuzione della carica virale dal periodo di controllo al periodo di monoterapia funzionale, in particolare confrontando la percentuale di pazienti con una diminuzione di ³0,5 log10 della carica virale complessiva. Durante il periodo di controllo, il 3% dei pazienti è risultato avere una tale diminuzione, mentre il periodo di monoterapia funzionale ha portato l’83% dei pazienti a soddisfare la diminuzione del carico virale dichiarato. Alla fine delle 25 settimane, il 43% dei pazienti ha raggiunto una carica virale di <50 copie/mL.16
Sulla base di questo studio, il dosaggio approvato di ibalizumab-uiyk è una dose di carico una tantum di 2.000 mg, seguita da una dose di mantenimento di 800 mg ogni 2 settimane.4,16 È richiesto un attento monitoraggio per 1 ora dopo la somministrazione della prima infusione per reazioni legate all’infusione, con un monitoraggio successivo ridotto a 15 minuti dopo la tolleranza della dose iniziale.4 Ibalizumab-uiyk sembra essere altrimenti ben tollerato; gli effetti più avversi associati a ibalizumab-uiyk sono stati nausea, vertigini e diarrea.4,16
Fostemsavir (Rukobia)
Fostemsavir è un nuovo ARV indicato per la terapia di combinazione in adulti HTE con HIV-1 MDR noto, in particolare per i pazienti che stanno fallendo l’attuale ART a causa di potenziale resistenza, intolleranza, o considerazioni sulla sicurezza.4 È il primo inibitore di attacco approvato dalla FDA. Dopo l’attivazione enzimatica alla molecola attiva temsavir, si lega alla gp120, una glicoproteina dell’involucro virale necessaria per l’attacco virale alle cellule CD4. Questo impedisce l’ingresso virale nelle cellule CD4, fermando efficacemente la replicazione virale. A causa di questo nuovo meccanismo, è improbabile che fostemsavir induca resistenza a se stesso attraverso la pressione selettiva associata alla maggior parte degli altri ARV.6,17
Fostemsavir è stato valutato sia per la sicurezza che per l’efficacia in uno studio clinico randomizzato, in doppio cieco, controllato con placebo (BRIGHTE) comprendente 371 pazienti HIV-1 HTE.16,17 I pazienti della coorte principale sono stati trattati sia con il loro regime ART di base sia con fostemsavir 600 mg due volte al giorno o con placebo per un totale di 8 giorni. Alla valutazione dell’8° giorno, i pazienti con fostemsavir hanno dimostrato livelli sierici significativamente più bassi di HIV-RNA virale. Dopo questo periodo iniziale di trattamento, tutti i pazienti sono passati a fostemsavir 600 mg due volte al giorno. Al termine delle 24 settimane, il 53% dei partecipanti allo studio ha raggiunto livelli effettivi di soppressione virale non rilevabili, con un miglioramento della soppressione al 60% alla settimana 96.17,18
L’effetto avverso più comunemente riportato da fostemsavir era la nausea. Reazioni più gravi, compresi gli aumenti degli enzimi epatici, sono stati riportati in pazienti con coinfezione da epatite B o C.17,18 Altri studi hanno riportato un’incidenza minore di mal di testa, rash e diarrea. Il metabolita attivo temsavir è metabolizzato dal CYP3A4, quindi i forti induttori come la carbamazepina, la rifampicina e l’erba di San Giovanni devono essere evitati per prevenire una diminuzione della concentrazione di temsavir nel siero.17-19
Bictegravir/Emtricitabina/TenofovirAlafenamide (Biktarvy)
Bictegravir/emtricitabina/tenofovir alafenamide (BIC/FTC/TAF) è una compressa di combinazione a dose fissa, una volta al giorno, contenente un nuovo inibitore dell’integrasi e due inibitori nucleosidici/nucleotidici della transcriptasi inversa. I singoli componenti di Biktarvy sono bictegravir 50 mg (un inibitore dell’integrasi), emtricitabina 200 mg (un NRTI) e tenofovir alafenamide 25 mg (un NRTI). BIC/FTC/TAF è indicato come regime completo in adulti con infezione da HIV-1 senza storia di ART o per sostituire l’attuale regime ART di pazienti che sono virologicamente soppressi (carica virale £50 copie per mL) con un regime ARV stabile per almeno 3 mesi e nessuna storia di fallimento del trattamento o resistenza ai suoi singoli componenti. Più significativamente, si tratta di un regime completo con una sola pillola che non richiede altri ARV.20
BIC/FTC/TAF è stato approvato nel 2018 dopo quattro studi clinici. Due degli studi clinici hanno testato l’efficacia e la sicurezza di BIC/FTC/TAF in pazienti senza storia di ART: Trial 1489 (randomizzato, BIC/FTC/TAF vs. abacavir/dolutegravir/lamivudina, e Trial 1490 (randomizzato, BIC/FTC/TAF vs. dolutegravir + emtricitabina/tenofovir alafenamide).21,22 Nello studio 1489, l’endpoint primario della carica virale <50 copie/mL è stato raggiunto nel 92% del gruppo BIC/FTC/TAF e nel 93% del gruppo ABC/DTG/3TC (differenza di trattamento di -0,6%; intervallo di confidenza al 95%, da -4,8% a 3,6%). Nello studio 1490, l’endpoint primario della carica virale <50 copie/mL è stato raggiunto nell’89% del gruppo BIC/FTC/TAF e nel 93% del gruppo DTG + FTC/TAF (differenza di trattamento di -3,5%; 95% CI, -7,9% a 1,0%).21,22
Gli altri due studi hanno testato l’efficacia e la sicurezza di BIC/FTC/TAF in pazienti virologicamente soppressi che sarebbero passati dai loro attuali regimi ART a BIC/FTC/TAF: Trial 1844 (randomizzato, passaggio da dolutegravir più abacavir/lamivudina o ABC/DTG/3TC a BIC/FTC/TAF) e Trial 1878 (in aperto, passaggio da atazanavir o darunavir potenziato più abacavir/emtricitabina o emtricitabina/tenofovir disoproxil fumarato a BIC/FTC/TAF).23,24 Nello studio 1844, l’endpoint primario dei pazienti che hanno perso il loro stato di soppressione virologica (carica virale ³50 copie per ml) è stato visto nell’1% del gruppo BIC/FTC/TAF e <1% del gruppo del regime originale (differenza di trattamento dello 0,7%, 95% CI, da -1,0% a 2,8%). Nello studio 1878, l’endpoint primario dei pazienti che hanno perso il loro stato di soppressione virologica è stato visto nel 2% del gruppo BIC/FTC/TAF e nel 2% del gruppo del regime originale (differenza di trattamento dello 0,0%; 95% CI, da -2,5% a 2,5%).23,24
BIC/FTC/TAF è dosato una volta al giorno per bocca con o senza cibo. Le reazioni avverse più comunemente riportate nei pazienti sono state diarrea, nausea e mal di testa.20-24
Dolutegravir/Lamivudina (Dovato)
La combinazione dolutegravir/lamivudina (DTG/3TC), un INSTI e NRTI, è stata approvata nel 2019. Si tratta del primo regime completo a due farmaci e a dose fissa per il trattamento dell’infezione da HIV-1 in pazienti adulti naïve al trattamento. Questo contrasta con le opzioni di regime standard di cura tradizionalmente richieste con tre farmaci. Questo può offrire un’opportunità ai pazienti che non possono tollerare nessuno dei più comuni regimi a tre farmaci a causa di effetti avversi o interazioni farmacologiche inevitabili.25,26
L’efficacia e la sicurezza della combinazione dolutegravir/lamivudina sono state dimostrate in due studi identici, GEMINI-1 e GEMINI-2.27 Questi studi hanno arruolato un totale di 1.433 adulti con infezione da HIV-1 e nativi al trattamento che sono stati randomizzati a ricevere un regime a due farmaci, dolutegravir 50 mg più lamivudina 150 mg, o un regime a tre farmaci, dolutegravir più emtricitabina più tenofovir disoproxil fumarato. L’endpoint primario del raggiungimento di una carica virale <50 copie/mL ha mostrato che DTG/3TC non era inferiore al 91% dei 716 pazienti con due farmaci e al 93% dei 717 pazienti con tre farmaci (differenza di trattamento di -1,7%; 95% CI, -4,4% a 1,1%) – quando i risultati dei due studi sono stati riuniti. Gli studi raggruppati hanno anche mostrato che, numericamente, meno pazienti hanno avuto eventi avversi correlati al farmaco nel regime a due farmaci rispetto al regime a tre farmaci (126 su 716 e 169 su 717, rispettivamente). Grazie all’efficacia non inferiore e a un profilo di tollerabilità simile, il Department of Health and Human Services ha potuto includere la combinazione a dose fissa DTG/3TC nelle linee guida sull’HIV/AIDS come regime iniziale raccomandato per la maggior parte delle persone con HIV.27
La combinazione dolutegravir/lamivudina viene dosata una volta al giorno per bocca con o senza cibo. Le reazioni avverse più comuni osservate nei pazienti sono mal di testa, nausea, diarrea, affaticamento e insonnia. Nonostante sia una compressa di combinazione a due farmaci, non c’è bisogno di somministrarla con altri farmaci ARV perché è un regime terapeutico completo.25-27
Emtricitabina/Tenofovir Alafenamide per la profilassi pre-esposizione (PrEP)
Dal 2012, l’unica opzione approvata dalla FDA per la PrEP è stata FTC/ TDF.11 Questo è cambiato nel 2019 con l’approvazione della combinazione emtricitabina/tenofovir alafenamide (FTC/TAF),13 un farmaco combinato strutturalmente simile. Ora è indicato per l’uso nella PrEP in pazienti non infetti ad alto rischio di trasmissione dell’HIV attraverso i rapporti sessuali. Questo esclude i pazienti a rischio da rapporti vaginali ricettivi, poiché questa popolazione non è ancora stata valutata.
L’approvazione della PrEP si basa sul recente studio DISCOVER, uno studio randomizzato, in doppio cieco che confronta FTC/TAF con FTC/TDF standard-of-care nel ridurre il rischio di acquisire l’infezione da HIV-1 in uomini e donne transgender che fanno sesso con uomini e sono a rischio di infezione da HIV-1.7 Lo studio è stato condotto come uno studio randomizzato, in doppio cieco, a gruppi paralleli con un follow-up minimo di 48 settimane, con almeno il 50% dei partecipanti che hanno 96 settimane di follow-up dopo la randomizzazione. Ha arruolato 5.399 partecipanti che sono stati randomizzati 1:1 in uno dei due gruppi. L’obiettivo primario dello studio era quello di valutare l’incidenza dell’infezione da HIV-1 per 100 anni-persona. Tra i 2.694 partecipanti al braccio FTC/TAF, l’incidenza dell’HIV-1 è stata osservata in 7 pazienti (0,16/100 anni-persona). Tra i 2.693 partecipanti al braccio FTC/TDF, l’incidenza dell’HIV-1 è stata osservata in 15 pazienti (0,34/100 anni-persona). Queste incidenze dimostrano che FTC/TAF non era inferiore a FTC/TDF nei partecipanti allo studio che erano a rischio di contrarre l’HIV e, in definitiva, hanno permesso alla FDA di aggiungere la PrEP alle indicazioni per FTC/TAF.13
Il posto di FTC/TAF nella terapia dell’HIV è probabilmente ancora poco chiaro. Sebbene abbia trovato impiego in altre aree del trattamento dell’HIV, il suo beneficio rispetto all’alternativa in questo contesto deve ancora essere definitivamente determinato. Anche se simile, il TAF può offrire una minore incidenza di cambiamenti della densità ossea e disfunzioni renali, effetti avversi associati al TDF. Questa differenza non è ben stabilita, tuttavia, con alcuni dati che suggeriscono che, nei regimi che non includono un booster farmacocinetico come cobicistat o ritonavir, questo beneficio potrebbe non essere clinicamente significativo. 27-29
Conclusione
A causa della complessità dell’HIV e del suo potenziale di resistenza, la terapia ARV può diventare rapidamente pesante per i pazienti. Tra il 2018 e oggi, la comunità medica ha visto un’ampia espansione delle terapie ARV approvate dalla FDA per il trattamento dell’HIV. Queste terapie includono nuove compresse combinate a dose fissa; nuovi farmaci che funzionano attraverso meccanismi diversi da quelli precedentemente sul mercato; e persino nuove indicazioni per farmaci precedentemente esistenti. Questi nuovi farmaci hanno già avuto un impatto sulle attuali linee guida di trattamento e possono aiutare i pazienti a vivere una vita più lunga e più sana.
Il contenuto di questo articolo è solo a scopo informativo. Il contenuto non vuole essere un sostituto della consulenza professionale. L’affidamento su qualsiasi informazione fornita in questo articolo è esclusivamente a proprio rischio.
1. Vella S, Schwartländer B, Sow SP, et al. La storia della terapia antiretrovirale e della sua implementazione in aree del mondo con risorse limitate. AIDS. 2012;26(10):1231-1241.
2. Arts EJ, Hazuda DJ. Terapia farmacologica antiretrovirale dell’HIV-1. Cold Spring Harb Perspect Med. 2012;2(4):a007161.
3. Chaudhuri S, Symons JA, Deval J. Innovazione e tendenze nello sviluppo e approvazione di farmaci antivirali: 1987-2017 e oltre. Antiviral Res. 2018;155:76-88.
4. Trogarzo (ibalizumab-uiyk) package insert. Montreal, Quebec: Theratechnologies Inc; marzo 2018.
5. Inserto informativo di Pifeltro (doravirina). Whitehouse Station, NJ: Merck & Co, Inc; marzo 2019.
6. Rukobia (fostemsavir) foglietto illustrativo. Research Triangle Park, NC: GlaxoSmithKline; luglio 2020.
7. Pan F, Chernew ME, Fendrick AM. Impatto dei farmaci di combinazione a dose fissa sull’aderenza ai farmaci prescritti. J Gen Intern Med. 2008;23(5):611-614.
8. Verma AA, Khuu W, Tadrous M, et al. Fixed-dose combinazione di farmaci antipertensivi, l’aderenza, e gli esiti clinici: una popolazione basata studio di coorte retrospettivo. PLoS Med. 2018;15(6):e1002584.
9. National Institutes of Health. HIVinfo. Farmaci HIV approvati dalla FDA. hivinfo.nih.gov/understanding-hiv/fact-sheets/fda-approved-hiv-medicines. Accessed September 22, 2020.
10. Prezista (darunavir) foglietto illustrativo. Titusville, NJ: Janssen Therapeutics; maggio 2019.
11. Truvada (emtricitabina/tenofovir disoproxil fumarato) foglietto illustrativo. Foster City, CA: Gilead Sciences, Inc; giugno 2004/2020.
12. Delstrigo (doravirina/lamivudina/tenofovir disproxil fumerate) foglietto illustrativo. Casa Bianca Starion, NJ: Merck & Co, Inc; agosto 2018.
13. Descovy (emtricitabina/tenofovir alafenamide) foglietto illustrativo. Foster City, CA: Gilead Sciences, Inc; dicembre 2019.
14. Tivicay (dolutegravir) foglietto illustrativo. Research Triangle Park, NC. GlaxoSmithKline; giugno 2020.
15. Iacob SA, Iacob DG. Ibalizumab che mira ai recettori CD4, una molecola emergente nella terapia dell’HIV. Front Microbiol. 2017;8:2323.
16. Emu B, Fessel J, Schrader S, et al. Studio di fase 3 di ibalizumab per HIV-1 multiresistente ai farmaci. N Engl J Med. 2018;379:645-654.
17. Li Z, Zhou N, Sun Y, et al. Attività dell’inibitore dell’attacco di HIV-1 BMS-626529, il componente attivo del prodrug BMS-663068, contro i virus CD4-indipendenti e gli involucri di HIV-1 resistenti ad altri inibitori di ingresso. Antimicrob Agents Chemother. 2013:57(9):4172-4180.
18. Kozal M, Aberg J, Pialoux G. Fostemsavir negli adulti con infezione da HIV-1 multiresistente ai farmaci. N Engl J Med. 2020;382(13):1232-1243.
19. Cahn P, Fink V, Patterson P. Fostemsavir: un nuovo inibitore dell’attacco CD4. Curr Opin HIV AIDS. 2018;13(4):341-345.
20. Biktarvy (bictecgravir/emtricitabina/tenofovir alafenamide) package insert. Foster City, CA: Gilead Sceinces, Inc; febbraio 2018.
21. Gallant J, Lazzarin A, Mills M, et al. Bictegravir, emtricitabina e tenofovir alafenamide contro dolutegravir, abacavir e lamivudina per il trattamento iniziale dell’infezione da HIV-1 (GS-US-380-1489): uno studio di non inferiorità in doppio cieco, multicentrico, di fase 3, randomizzato controllato. Lancet. 2017;390(10107):2063-2072.
22. Sax PE, Pozniak A, Montes M, et al. Bictegravir coformulato, emtricitabina e tenofovir alafenamide versus dolutegravir con emtricitabina e tenofovir alafenamide, per il trattamento iniziale dell’infezione da HIV-1 (GS-US-380-1490): uno studio randomizzato, in doppio cieco, multicentrico, fase 3, non-inferiorità. Lancet. 2017;390(10107):2073-2082.
23. Malina JM, Ward D, Brar I, et al. Passaggio a bictegravir a dose fissa, emtricitabina e tenofovir alafenamide da dolutegravir più abacavir andlamivudina in adulti virologicamente soppressi con HIV-1: risultati a 48 settimane di uno studio randomizzato, in doppio cieco, multicentrico, controllato attivamente, di fase 3, non-inferiorità. Lancet HIV. 2018;5(7):E357-E365.
24. Daar ES, De Jesus E, Ruane P, et al. Efficacia e sicurezza del passaggio a bictegravir a dose fissa, emtricitabina e tenofovir alafenamide da regimi a base di inibitori della proteasi potenziati in adulti virologicamente soppressi con HIV-1: risultati a 48 settimane di uno studio randomizzato, open-label, multicentrico, di fase 3, non-inferiorità. Lancet HIV. 2018;5(7):e347-e356.
25. Dovato (dolutegravir/lamivudina) foglietto illustrativo. Research Triangle Park, NC: GlaxoSmithKline. Marzo 2020.
26. Scott LJ. Dolutegravir/lamivudina regime in singola compressa: una revisione nell’infezione da HIV-1. Farmaci. 2020;80(1):61-72.
27. Cahn P, Madero JS, Arribas JR, et al. GEMINI Study Team. Dolutegravir più lamivudina contro dolutegravir più tenofovir disoproxil fumarato ed emtricitabina in adulti nativi di antiretrovirali con infezione da HIV-1 (GEMINI-1 e GEMINI-2): risultati della settimana 48 di due studi multicentrici, in doppio cieco, randomizzati, non-inferiorità, fase 3. Lancet. 2019;393(10167):143-155.
28. Mayer KH, Molina JM, Thompson MA, et al. Emtricitabina e tenofovir alafenamide vs. emtricitabina e tenofovir disoproxil fumarato per la profilassi pre-esposizione all’HIV (DISCOVER): risultati primari di uno studio di non inferiorità di fase 3 randomizzato, in doppio cieco, multicentrico, controllato attivamente. Lancet. 2020;396(10246):239-254.
29. Hill A, Hughes SL, Gotham D, Pozniak AL. Tenofovir alafenamide contro tenofovir disoproxil fumarato: c’è una vera differenza di efficacia e sicurezza? J Virus Erad. 2018;4(2):72-79.