VIVO 病態生理
インスリンの構造
インスリンはA鎖およびB鎖と呼ばれる2本のペプチド鎖から構成されています。 A鎖とB鎖は2つのジスルフィド結合で結ばれており、A鎖の中にはさらに1つのジスルフィドが形成されている。
インスリンのアミノ酸配列は生物種によって異なりますが、3つのジスルフィド結合の位置、A鎖の両端、B鎖のC末端残基など、分子の特定のセグメントは高度に保存されています。 このようなインスリンのアミノ酸配列の類似性から、インスリンの3次元的なコンフォメーションは種間で非常に似ており、ある動物からのインスリンは他の種でも生物学的に活性である可能性が非常に高い。 実際、ブタのインスリンは人間の患者の治療に広く使われている。
インスリン分子は、B鎖のC末端間の水素結合により、溶液中で二量体を形成する性質がある。 さらに、亜鉛イオンの存在下では、インスリン二量体は六量体に会合する。
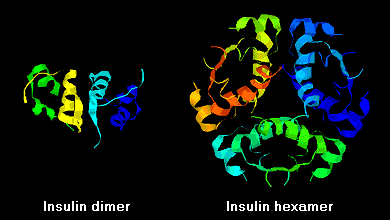
これらの相互作用は、臨床上重要な意味を持つ。 単量体や二量体は容易に血中に拡散するが、六量体は拡散しにくい。 そのため、6量体を多く含むインスリン製剤の吸収は遅れ、やや時間がかかる。 この現象は、特に、多くのリコンビナントインスリンアナログの開発を刺激した。 これらの分子の中で最初に上市されたインスリンリスプロは、B鎖のC末端のリジンとプロリン残基が逆になるように設計されている。この修飾は受容体結合を変化させないが、二量体と六量体を形成する傾向を最小にする。