Op 28 november beweerde He Jiankui voor een volle conferentiezaal op de Tweede Internationale Top over het bewerken van het menselijk genoom in Hongkong het genoom te hebben bewerkt van twee tweelingmeisjes, Lulu en Nana, die in China waren geboren.
Wetenschappers van de Southern University of Science and Technology in Guangdong, China, veroordeelden He’s onderzoek door te stellen dat hij “de academische ethiek en gedragscodes ernstig heeft geschonden”, en filosofen en bio-ethici doken al snel in het moeras van het bewerken van menselijke genomen. Dus ik ga daar niet op in. Wat ik wil bespreken is wat we hebben geleerd: hoe Hij deze baby’s heeft gemaakt.
Ik ben theoretisch gepensioneerd hoogleraar aan de afdeling Biomedische Wetenschappen van de Colorado State University. Ik heb meer dan 50 jaar onderzoek gedaan naar talrijke aspecten van geassisteerde voortplantingstechnologie, waaronder klonen en het aanbrengen van genetische veranderingen in zoogdierembryo’s, dus ik ben geïnteresseerd in vrijwel elk onderzoek naar “designer baby’s” en de gezondheidsproblemen die zij kunnen ondervinden.
Een primeur?
Op de conferentie gaf hij een algemeen overzicht van de wetenschap. Hoewel onderzoek als dit gewoonlijk aan de wetenschappelijke gemeenschap wordt gepresenteerd door publicatie in een door vakgenoten beoordeeld tijdschrift, hetgeen hij beweert van plan te zijn, kunnen wij een globaal idee krijgen van de wijze waarop hij deze gemodificeerde baby’s heeft gemaakt. Dit is iets dat met succes is gedaan bij andere diersoorten en vorig jaar nog bij menselijke embryo’s – maar deze laatste werden niet bij een vrouw geïmplanteerd. Hij zegt dat hij drie jaar heeft besteed aan het testen van de procedure op muizen en apen voordat hij overging op het werken met menselijke embryo’s.
Er bestaat geen twijfel over dat nauwkeurige genetische modificaties kunnen worden aangebracht in menselijk sperma, eicellen, embryo’s en zelfs in sommige cellen van volwassenen. Dergelijke modificaties zijn ad nauseum uitgevoerd bij muizen, varkens en diverse andere zoogdieren. Voor wetenschappers als ik is het dan ook duidelijk dat diezelfde genetische modificaties ook bij mensen kunnen en zullen worden aangebracht. De gemakkelijkste manier om genetische veranderingen aan te brengen begint bij het embryo.
De gereedschapskist
De meest trendy strategie om DNA te veranderen is tegenwoordig het CRISPR/Cas-9 gene editing tool, dat precieze genetische veranderingen kan aanbrengen in levende cellen. Hoewel andere hulpmiddelen al jaren beschikbaar zijn, is de CRISPR/Cas-9-benadering eenvoudiger, gemakkelijker, nauwkeuriger en minder duur.
De manier waarop het werkt is eenvoudig in concept. Het Cas-9 onderdeel is een moleculaire schaar die het DNA knipt op de plaats die is aangegeven door een klein stukje RNA, het “CRISPR-sjabloon” genoemd. Zodra het DNA is doorgesneden, kan een gen op die plaats worden gewijzigd. De snede wordt vervolgens gerepareerd door enzymen die al in de cellen aanwezig zijn.
In dit geval richtte hij zich op een gen dat een eiwit op het celoppervlak produceert dat CCR5 wordt genoemd. Het HIV-virus gebruikt dit eiwit om zich aan de cel te hechten en de cel te infecteren. Zijn idee was CCR5 genetisch te veranderen zodat HIV geen cellen meer kan infecteren, waardoor de meisjes resistent worden tegen het virus.
Op dit moment heeft hij nog geen duidelijke uitleg gegeven over hoe hij CCR5 precies heeft uitgeschakeld en wat de aard van de genetische modificatie was. Maar dit soort “uitschakeling” wordt routinematig gebruikt bij onderzoek.
Hoe hij het deed
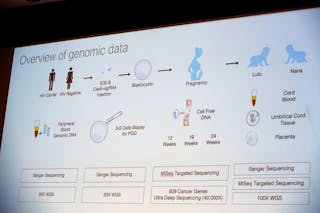
Uit het schema dat hij presenteerde, blijkt dat hij het CRISPR/Cas-9-systeem in een eicel injecteerde op hetzelfde moment dat hij een sperma injecteerde om het te bevruchten. Hierna splitste de eicel zich en vormde een bal van tientallen cellen – het embryo. In dit stadium verwijderde hij een paar cellen uit elk embryo om te bepalen of de gewenste genetische verandering was aangebracht. Gebaseerd op mijn ervaring, waren de embryo’s waarschijnlijk op dit punt ingevroren. Toen de analyse voltooid was, heeft hij waarschijnlijk de gewijzigde embryo’s ontdooid en de beste teruggeplaatst in de baarmoeder van de moeder voor een zwangerschap tot het einde. Embryo’s zonder de bewerkingen of met onjuiste bewerkingen zouden ofwel worden weggegooid ofwel voor onderzoek worden gebruikt.
Voor veel toepassingen is het ideaal om eventuele wijzigingen in de genen in het eencellig stadium aan te brengen. Wanneer het embryo vervolgens zijn DNA dupliceert en zich deelt om een tweecellig embryo te maken, wordt de genetische wijziging ook gedupliceerd. Dit gaat zo door dat elke cel in de resulterende baby de genetische verandering heeft.
Het lijkt er echter op dat de genetische modificatie in dit geval pas in het tweecellig stadium of later is opgetreden, omdat sommige cellen in de baby’s de modificatie wel hadden en andere niet. Deze situatie wordt mozaïcisme genoemd omdat het kind een mozaïek is van normale en gemodificeerde cellen.
Gevaren van embryo-bewerking?
Wat kan er misgaan in een genetisch gemodificeerd embryo? Genoeg.
De eerste hapering is dat er geen wijziging is aangebracht, wat vaak voorkomt. Een variatie is dat de verandering optreedt in sommige cellen van het embryo, maar niet in alle cellen, zoals gebeurde bij deze baby’s.
De meest voorkomende zorg zijn de zogeheten non-target-effecten, waarbij de genetische modificatie wel wordt aangebracht, maar op andere plaatsen in het genoom onbedoelde wijziging(en) optreedt (optreden). Een modificatie op de verkeerde plaats kan allerlei ontwikkelingsproblemen veroorzaken, zoals abnormale orgaanontwikkeling, miskramen en zelfs kanker.
Uit zijn dia blijkt dat hij de genomen – de volledige genetische blauwdruk voor elk kind – in meerdere stadia van de zwangerschap heeft gesequeneerd om te bepalen of er ongewenste modificaties waren, hoewel die niet altijd gemakkelijk te vinden zijn. Maar totdat onafhankelijke wetenschappers het DNA van deze twee babymeisjes kunnen onderzoeken, zullen we de resultaten niet kennen. Uit de resultaten die hij tot nu toe heeft gedeeld, wordt ook niet duidelijk of deze genetische verandering op de volgende generatie kan worden overgedragen.
Een ander veelvoorkomend probleem waarop al is gezinspeeld, is mozaïcisme, wat bij een van deze tweelingen lijkt te zijn gebeurd. Als sommige cellen worden bewerkt en andere niet, kan de baby bijvoorbeeld levercellen hebben die het bewerkte gen bevatten en hartcellen die de normale versie hebben. Dit kan al dan niet tot ernstige problemen leiden.

Een ander probleem is dat het manipuleren van embryo’s in vitro – buiten hun normale omgeving in het voortplantingskanaal, waar we de normale voeding, zuurstofniveaus, hormonen en groeifactoren niet precies kunnen namaken – kan leiden tot ontwikkelingsstoornissen, waaronder te grote foetussen, metabolische problemen, enzovoort. Dit gebeurt soms bij routineprocedures zoals in-vitrofertilisatie, wanneer niet wordt geprobeerd genetische modificaties aan te brengen.
Gelukkig genoeg is de natuur heel goed in het uitwieden van abnormale embryo’s via embryonale sterfte en spontane abortus. Zelfs in gezonde menselijke populaties die zich normaal voortplanten, sterft bijna de helft van de embryo’s voordat de vrouw zelfs maar weet dat ze zwanger was.
We ontwerpen al baby’s – en er zijn voordelen
Hoewel ik heb benadrukt wat er mis kan gaan, geloof ik dat de wetenschap zich zo zal ontwikkelen dat genetisch gemodificeerde baby’s gezonder zullen zijn dan niet-gemodificeerde. En deze verbeteringen zullen worden doorgegeven aan toekomstige generaties. Ernstig invaliderende genetische afwijkingen zoals het Tay-Sachs syndroom zouden door genetische modificatie uit een familie kunnen worden verwijderd.
Waarschijnlijk worden er nu al designer baby’s geboren met behulp van een techniek die pre-implantatie genetische diagnoses (PGD) wordt genoemd. Enkele cellen van embryo’s worden gescreend op tientallen, en mogelijk honderden, genetische afwijkingen, zoals het syndroom van Down, taaislijmziekte en het Tay-Sachs syndroom, om er maar een paar te noemen. Ouders kunnen ook kiezen welke embryo’s van het gewenste geslacht zijn. Naar mijn mening is het kiezen van embryo’s om te implanteren duidelijk het maken van designer baby’s.
Gezien een stap verder, is PGD niet beperkt tot het elimineren van ziekte. Een aanstaande ouder kan ook andere eigenschappen kiezen. Als een van de aanstaande ouders onvruchtbaar is, zijn er catalogi die het ras, de lengte en het gewicht, en zelfs het opleidingsniveau van een sperma- of eiceldonor geven, van wie ook is vastgesteld dat hij vrij is van grote genetische afwijkingen, en vrij van AIDS en andere geslachtsziekten.

Als de procedures ethisch en moreel aanvaardbaar worden geacht, zullen de meeste genetische modificaties die waarschijnlijk zullen worden aangebracht bij het bewerken van embryo’s, zoals hij zegt te hebben gedaan, eerder bestaan uit het verwijderen van schadelijke eigenschappen dan uit het toevoegen van wenselijke eigenschappen. Omdat de veranderingen doelgericht zullen zijn, zullen ze nauwkeuriger en minder schadelijk zijn dan de mutaties die willekeurig in het DNA van in wezen alle sperma en eicellen op natuurlijke wijze optreden.
Bij al deze voortplantingstechnologie is er nog een andere overweging: de enorme kosten van de beschreven procedures. In hoeverre moet de samenleving schaarse medische middelen investeren in de toepassing van dergelijke technieken, vooral omdat eventuele voordelen waarschijnlijk vooral ten goede zullen komen aan rijkere gezinnen?
Deze perspectieven moeten in gedachten worden gehouden bij het evalueren van potentiële genetische manipulaties van mensen.