ABSTRACT: De beschikbare antiretrovirale (ARV) geneesmiddelen voor de behandeling van hiv zijn sinds 2018 uitgebreid. Er zijn nieuwe soorten ARV’s met nieuwe werkingsmechanismen goedgekeurd, waaronder ibalizumab-uiyk en fostemsavir. Er zijn ook goedkeuringen geweest van combinatietabletten van eerder beschikbare geneesmiddelen, zoals bictegravir/emtricitabine/tenofovir alafenamide en dolutegravir/lamivudine. Ten slotte is er een uitbreiding geweest van de goedgekeurde indicaties voor eerder beschikbare ARV’s zelf, zoals emtricitabine/tenofovir alafenamide voor gebruik in pre-exposure profylaxe.
US Pharm. 2020:45(10):17-25.
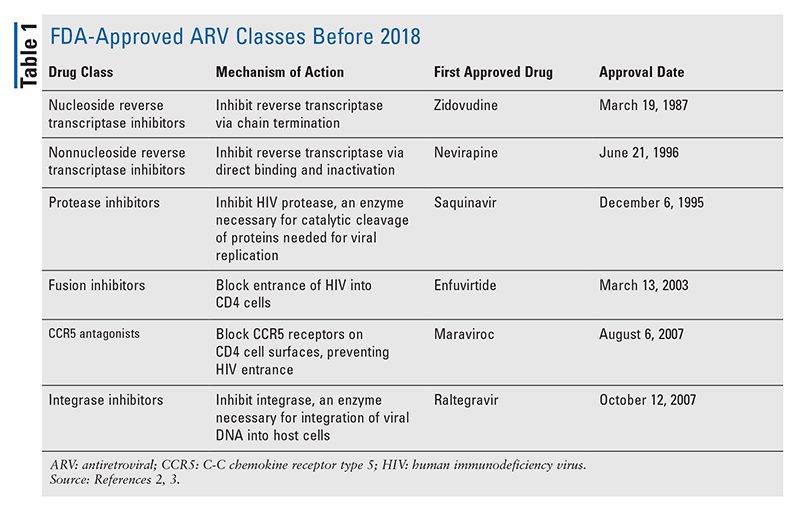
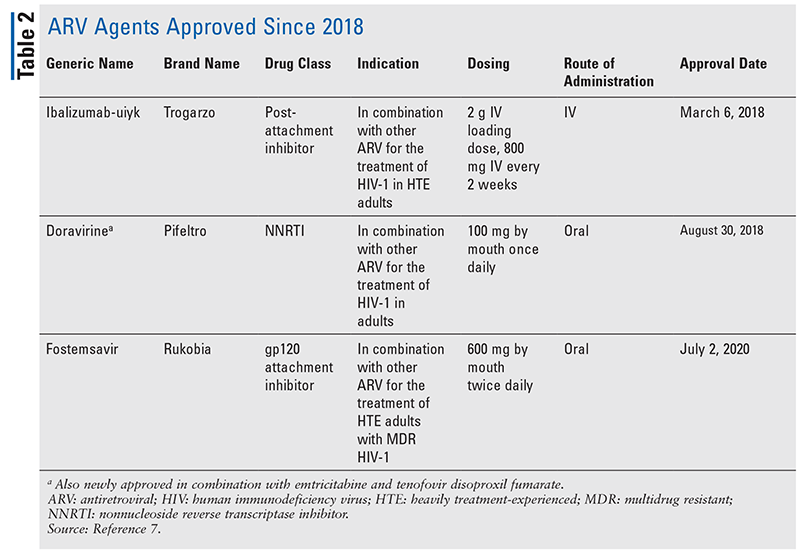
De belangrijkste pijlers van antiretrovirale (ARV) middelen voor de behandeling van hiv bestaan al jaren grotendeels uit dezelfde handvol klassen van geneesmiddelen. HIV-behandeling werd voor het eerst geprobeerd met nucleoside reverse transcriptase inhibitors (NRTI’s), de eerste door de FDA goedgekeurde klasse van ARV’s. Geleidelijk aan werden steeds meer klassen ontdekt en beschikbaar gesteld voor behandeling in verschillende, vaak complexe, regimes (TABEL 1).1-3 Na de goedkeuring van raltegravir in 2007, waren nieuwe goedkeuringen van hiv-geneesmiddelen grotendeels voor hergebruikte beschikbare geneesmiddelen en nieuwe combinatiegeneesmiddelen. Dit veranderde in 2018 met de goedkeuring van ibalizumab-uiyk, het eerste nieuwe ARV in meer dan een decennium.4 Ibalizumab-uiyk werd snel gevolgd door een nieuwe nonnucleoside reverse transcriptaseremmer (NNRTI), doravirine, later dat jaar en een nieuwe koppelingsremmer, fostemsavir, in 2020 (TABEL 2).5-7
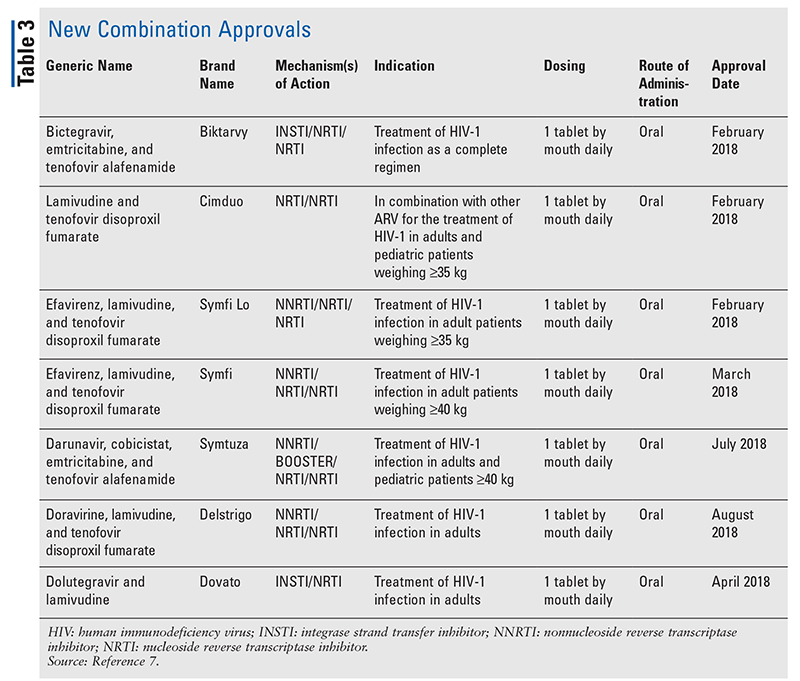
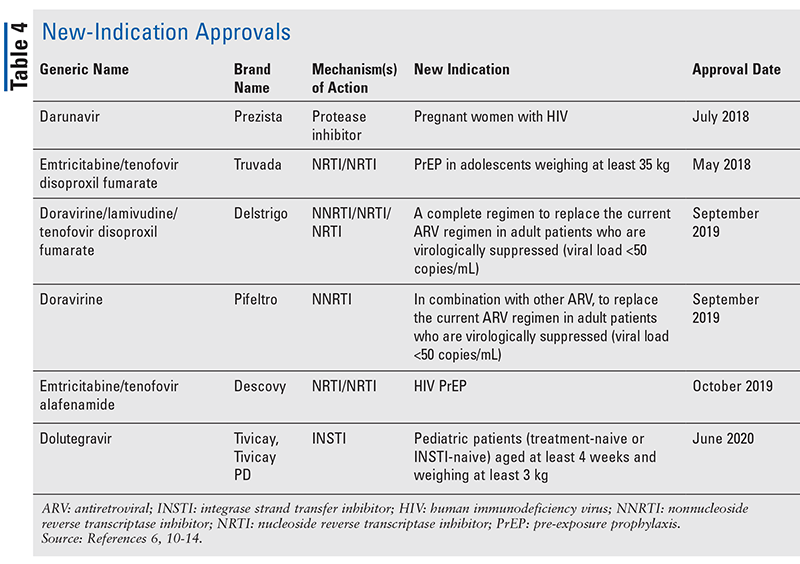
Hoewel nieuwe geneesmiddelen vaak de meest opwindende nieuwe goedkeuringen van geneesmiddelen zijn, zijn ARV’s op andere manieren verbeterd. Gezien de enorme hoeveelheid pillen die veel hiv-remmers moeten slikken, kunnen de onlangs goedgekeurde combinatie-antivirale middelen (TABEL 3) het leven van patiënten een stuk gemakkelijker maken. Het gebruik van dergelijke middelen en het beperken van de noodzakelijke pillenlast hebben verbeterde therapietrouw en algemene resultaten aangetoond.8,9 Er zijn ook uitbreidingen geweest in goedgekeurde indicaties voor eerder beschikbare ARV’s (TABEL 4), die nieuwe opties bieden voor bepaalde patiëntenpopulaties en indicaties.10-14
Hoewel er veel nieuwe goedkeuringen zijn sinds 2018, profileert dit artikel vier van de nieuw goedgekeurde medicijnen en één nieuwe indicatie. Deze goedkeuringen zijn geselecteerd om een voorbeeld te tonen van de grote verscheidenheid aan nieuwe middelen die beschikbaar komen, evenals het benadrukken van enkele nieuwe opties die een unieke kans bieden in de behandeling van hiv.
Ibalizumab-Uiyk (Trogarzo)
Ibalizumab-uiyk is een injecteerbaar recombinant monoklonaal antilichaam dat zich bindt aan de oppervlakte-eiwitten van CD4-cellen, wat leidt tot conformationele veranderingen die de posthechtingsstappen voorkomen die nodig zijn voor hiv-1-fusie en binnendringing in de cel. Het is het enige monoklonale geneesmiddel dat voor de behandeling van HIV wordt gebruikt. Door zijn unieke bindingspecificiteit blokkeert ibalizumab-uiyk de virusinsleep zonder immunosuppressie te veroorzaken, wat bij veel monoklonale geneesmiddelen een probleem is.4,15 Het is geïndiceerd in combinatie met andere ARV’s voor de behandeling van zwaar behandelde (HTE) volwassenen met multidrugresistent (MDR) HIV-1 bij wie hun huidige ARV-therapieregime faalt.4
De goedkeuring van ibalizumab-uiyk was gebaseerd op een studie uitgevoerd bij 40 HIV-HTE-patiënten met een viral load van meer dan 1000 kopieën/mL en een gedocumenteerde resistentie tegen ten minste één NRTI, NNRTI en een proteaseremmer. De patiënten moesten ook ten minste 6 maanden zijn behandeld en recentelijk geen therapie hebben gekregen. De proef omvatte drie perioden, beginnend met een periode van 6 dagen waarin de viral load aan de basis werd vastgesteld en bevestigd (controleperiode). Op dag 7 kregen de patiënten een laaddosis van 2.000 mg ibalizumab-uiyk naast hun standaard ART-kuur (functionele monotherapieperiode). Op dag 14 werd de viral load opnieuw bepaald en werden de schema’s gecontroleerd en aangepast om de juiste activiteit tegen hun HIV-infectie te garanderen. Ibalizumab-uiyk 800 mg werd elke 2 weken IV toegediend tot het einde van de studie (onderhoudsperiode). Het primaire eindpunt evalueerde het verschil in de proportie daling van de viral load tussen de controleperiode en de functionele monotherapieperiode, waarbij specifiek het percentage patiënten werd vergeleken met een daling van ³0,5 log10 in de totale viral load. Tijdens de controleperiode bleek 3% van de patiënten een dergelijke afname te hebben, terwijl de functionele monotherapieperiode resulteerde in 83% van de patiënten die voldeden aan de vermelde afname van de viral load. Aan het einde van de 25 weken bereikte 43% van de patiënten een viral load van <50 kopieën/mL.16
Op basis van deze studie is de goedgekeurde dosering van ibalizumab-uiyk een eenmalige IV laaddosis van 2000 mg, gevolgd door een IV onderhoudsdosis van 800 mg om de 2 weken.4,16 Zorgvuldige controle is vereist gedurende 1 uur na toediening van het eerste infuus voor infusie-gerelateerde reacties, met daaropvolgende infusiecontrole teruggebracht tot 15 minuten na tolerantie van de eerste dosis.4 Ibalizumab-uiyk lijkt verder goed te worden verdragen; de meest met ibalizumab-uiyk geassocieerde bijwerkingen waren misselijkheid, duizeligheid en diarree.4,16
Fostemsavir (Rukobia)
Fostemsavir is een nieuw ARV dat is geïndiceerd voor combinatietherapie bij HTE-volwassenen met bekende MDR HIV-1, specifiek voor patiënten bij wie de huidige ART faalt als gevolg van mogelijke resistentie, intolerantie of veiligheidsoverwegingen.4 Het is de eerste door de FDA goedgekeurde hechtingsremmer. Na enzymatische activering tot de actieve molecule temsavir bindt het zich aan gp120, een virale envelopglycoproteïne die nodig is voor virale binding aan CD4-cellen. Dit voorkomt dat het virus CD4-cellen binnendringt, waardoor de virale replicatie effectief wordt gestopt. Vanwege dit nieuwe mechanisme is het onwaarschijnlijk dat fostemsavir resistentie tegen zichzelf induceert door de selectieve druk die geassocieerd wordt met de meeste andere ARV’s.6,17
Fostemsavir werd geëvalueerd op zowel veiligheid als werkzaamheid in een gerandomiseerde, dubbelblinde, placebogecontroleerde klinische studie (BRIGHTE) met 371 HTE HIV-1-patiënten.16,17 Patiënten in het hoofdcohort werden gedurende in totaal 8 dagen behandeld met zowel hun baseline ART regime als ofwel fostemsavir 600 mg tweemaal daags ofwel placebo. Bij beoordeling op dag 8 toonden fostemsavir patiënten significant lagere serumspiegels van viraal HIV-RNA. Na deze initiële behandelingsperiode werden alle patiënten overgezet op fostemsavir 600 mg tweemaal daags. Na 24 weken bereikte 53% van de deelnemers aan de studie een effectief ondetecteerbaar niveau van virale onderdrukking, met een verbetering van de onderdrukking tot 60% in week 96.17,18
De meest gemelde bijwerking van fostemsavir was misselijkheid. Ernstigere reacties, waaronder verhogingen van leverenzymen, werden gemeld bij patiënten met een hepatitis B- of C-co-infectie.17,18 Andere studies meldden een geringe incidentie van hoofdpijn, huiduitslag, en diarree. De actieve metaboliet temsavir wordt gemetaboliseerd door CYP3A4, dus sterke inducers zoals carbamazepine, rifampine en sint-janskruid moeten worden vermeden om een verlaagde serumtemsavirconcentratie te voorkomen.17-19
Bictegravir/Emtricitabine/TenofovirAlafenamide (Biktarvy)
Bictegravir/emtricitabine/tenofovir alafenamide (BIC/FTC/TAF) is een vast gedoseerde, eenmaal daagse combinatietablet die een nieuwe integraseremmer en twee nucleoside/nucleotide reverse transcriptaseremmers bevat. De afzonderlijke bestanddelen van Biktarvy zijn bictegravir 50 mg (een integrase strandtransferremmer), emtricitabine 200 mg (een NRTI) en tenofovir alafenamide 25 mg (een NRTI). BIC/FTC/TAF is geïndiceerd als een compleet regime bij met HIV-1 geïnfecteerde volwassenen zonder voorgeschiedenis van ART of ter vervanging van het huidige ART-regime van patiënten die virologisch onderdrukt zijn (viral load £50 kopieën per ml) op een stabiel ARV-regime gedurende ten minste 3 maanden en geen voorgeschiedenis van falende behandeling of resistentie tegen de afzonderlijke componenten. Het meest significante is dat het een éénpillig, compleet regime is dat geen andere ARV’s vereist.20
BIC/FTC/TAF werd in 2018 goedgekeurd na vier klinische onderzoeken. Twee van de klinische studies testten de werkzaamheid en veiligheid van BIC/FTC/TAF bij patiënten zonder ART-geschiedenis: Trial 1489 (gerandomiseerd, BIC/FTC/TAF vs. abacavir/ dolutegravir/lamivudine, en Trial 1490 (gerandomiseerd, BIC/FTC/TAF vs. dolutegravir + emtricitabine/tenofovir alafenamide ).21,22 In Trial 1489 werd het primaire eindpunt van viral load <50 kopieën/mL bereikt in 92% van de BIC/FTC/TAF-groep en 93% van de ABC/DTG/3TC-groep (behandelingsverschil van -0,6%; 95%-betrouwbaarheidsinterval , -4,8% tot 3,6%). In proef 1490 werd het primaire eindpunt van viral load <50 kopieën/mL bereikt in 89% van de BIC/FTC/TAF-groep en 93% van de DTG + FTC/TAF-groep (behandelingsverschil van -3,5%; 95% CI, -7,9% tot 1,0%).21,22
De andere twee trials testten de werkzaamheid en veiligheid van BIC/FTC/TAF bij virologisch onderdrukte patiënten die van hun huidige ART-regimes zouden worden overgeschakeld op BIC/FTC/TAF: Trial 1844 (gerandomiseerd, overschakeling van dolutegravir plus abacavir/lamivudine of ABC/DTG/3TC naar BIC/FTC/TAF) en Trial 1878 (open-label, overschakeling van atazanavir of boosted darunavir plus abacavir/emtricitabine of emtricitabine/tenofovir disoproxil fumaraat naar BIC/FTC/TAF).23,24 In proef 1844 werd het primaire eindpunt van patiënten die hun virologische suppressiestatus verloren (viral load ³50 kopieën per ml) gezien bij 1% van de BIC/FTC/TAF-groep en <1% van de oorspronkelijke regimegroep (behandelingsverschil van 0,7%, 95% CI, -1,0% tot 2,8%). In proef 1878 werd het primaire eindpunt van patiënten die hun virologische suppressiestatus verloren, gezien bij 2% van de BIC/FTC/TAF-groep en 2% van de oorspronkelijke regimegroep (behandelingsverschil van 0,0%; 95% CI, -2,5% tot 2,5%).23,24
BIC/FTC/TAF wordt eenmaal daags via de mond toegediend, met of zonder voedsel. De meest gemelde bijwerkingen die bij patiënten werden waargenomen, waren diarree, misselijkheid en hoofdpijn.20-24
Dolutegravir/Lamivudine (Dovato)
Combinatie dolutegravir/lamivudine (DTG/3TC), een INSTI en NRTI, werd in 2019 goedgekeurd. Het is het eerste complete tweedrugsregime met vaste doses voor de behandeling van hiv-1-infectie bij behandelings-naïeve volwassen patiënten. Dit staat in contrast met de traditioneel vereiste drie-drugs standard-of-care regimen opties. Dit kan mogelijkheden bieden voor patiënten die geen van de meer gebruikelijke drievoudige schema’s kunnen verdragen vanwege bijwerkingen of onvermijdelijke interacties tussen geneesmiddelen.25,26
De werkzaamheid en veiligheid van de combinatie dolutegravir/lamivudine werden aangetoond in twee identieke studies, GEMINI-1 en GEMINI-2.27 Aan deze studies namen in totaal 1.433 HIV-1-geïnfecteerde, behandelings-naïeve volwassenen deel die werden gerandomiseerd naar een twee-medicijnregime, dolutegravir 50 mg plus lamivudine 150 mg, of een drie-medicijnregime, dolutegravir plus emtricitabine plus tenofovir disoproxil fumaraat. Het primaire eindpunt, het bereiken van een viral load <50 kopieën/mL, liet zien dat DTG/3TC niet-inferieur was-91% van de 716 patiënten met twee medicijnen en 93% van de 717 patiënten met drie medicijnen (verschil in behandeling van -1,7%; 95% CI, -4,4% tot 1,1%)-wanneer de resultaten van de twee studies werden samengevoegd. De gepoolde studies toonden ook aan dat numeriek gezien minder patiënten geneesmiddelgerelateerde bijwerkingen hadden bij de twee-medicamenteuze behandeling dan bij de drie-medicamenteuze behandeling (respectievelijk 126 van 716 en 169 van 717). Vanwege de niet-inferieure werkzaamheid en een vergelijkbaar verdraagbaarheidsprofiel kon het Department of Health and Human Services de combinatie DTG/3TC met vaste doses opnemen in de HIV/AIDS-richtlijnen als een aanbevolen aanvangsregime voor de meeste mensen met HIV.27
De combinatie dolutegravir/lamivudine wordt eenmaal daags via de mond gedoseerd, met of zonder voedsel. De meest voorkomende bijwerkingen bij patiënten zijn hoofdpijn, misselijkheid, diarree, vermoeidheid en slapeloosheid. Ondanks het feit dat het een combinatietablet met twee medicijnen is, is het niet nodig om het met andere ARV-medicijnen toe te dienen omdat het een volledig therapieregime is.25-27
Emtricitabine/Tenofovir Alafenamide voor Pre-exposure Prophylaxis (PrEP)
Sinds 2012 is de enige door de FDA goedgekeurde optie voor PrEP FTC/ TDF.11 Dit veranderde in 2019 met de goedkeuring van de combinatie emtricitabine/tenofovir alafenamide (FTC/TAF),13 een structureel vergelijkbaar combinatiemedicijn. Het is nu geïndiceerd voor gebruik in PrEP bij niet-geïnfecteerde patiënten die een hoog risico lopen op hiv-overdracht via geslachtsgemeenschap. Dit sluit patiënten uit die risico lopen op receptieve vaginale geslachtsgemeenschap, omdat deze populatie nog niet is geëvalueerd.
De goedkeuring van PrEP is gebaseerd op de recente DISCOVER-studie, een gerandomiseerde, dubbelblinde studie waarin FTC/TAF werd vergeleken met standaard FTC/TDF in het verminderen van het risico op het krijgen van een HIV-1-infectie bij mannen en transgendervrouwen die seks hebben met mannen en een risico op HIV-1-infectie lopen.7 De studie werd uitgevoerd als een gerandomiseerde, dubbelblinde, parallelle-groepstudie met een minimale follow-up van 48 weken, waarbij ten minste 50% van de deelnemers 96 weken follow-up hadden na de randomisatie. Er werden 5.399 deelnemers ingeschreven die 1:1 in een van beide groepen werden gerandomiseerd. Het primaire doel van de studie was de incidentie van HIV-1 infectie per 100 persoonsjaren te beoordelen. Onder de 2.694 deelnemers in de FTC/TAF-arm werd de HIV-1 incidentie waargenomen bij 7 patiënten (0,16/100 persoonsjaren). Onder de 2.693 deelnemers in de FTC/TDF-arm werd HIV-1-incidentie waargenomen bij 15 patiënten (0,34/100 persoonsjaren). Deze incidenties tonen aan dat FTC/TAF niet inferieur was aan FTC/TDF bij studiedeelnemers die het risico liepen hiv te krijgen, en uiteindelijk kon de FDA PrEP toevoegen aan de indicaties voor FTC/TAF.13
De plaats van FTC/TAF in hiv-therapie is waarschijnlijk nog onduidelijk. Hoewel het op andere gebieden van de HIV-behandeling is gebruikt, moet het voordeel ervan ten opzichte van het alternatief in deze setting nog onomstotelijk worden vastgesteld. Hoewel vergelijkbaar, kan de TAF een lagere incidentie van veranderingen in de botdichtheid en nierdisfunctie bieden, bijwerkingen die in verband worden gebracht met TDF. Dit verschil is echter niet goed vastgesteld, waarbij sommige gegevens suggereren dat dit voordeel bij regimes die geen farmacokinetische booster zoals cobicistat of ritonavir bevatten, klinisch niet significant is. 27-29
Conclusie
Door de complexiteit van hiv en zijn resistentiepotentieel kan ARV-therapie snel belastend worden voor patiënten. Tussen 2018 en nu heeft de medische gemeenschap een grote uitbreiding gezien van door de FDA goedgekeurde ARV-therapieën voor de behandeling van hiv. Deze therapieën omvatten nieuwe combinatietabletten met vaste doses; nieuwe geneesmiddelen die werken via andere mechanismen dan die eerder op de markt waren; en zelfs nieuwe indicaties voor eerder bestaande medicijnen. Deze nieuwe medicijnen hebben al invloed gehad op de huidige behandelingsrichtlijnen en kunnen patiënten helpen langer en gezonder te leven.
De inhoud van dit artikel is alleen voor informatieve doeleinden. De inhoud is niet bedoeld als vervanging van professioneel advies. Het vertrouwen op enige informatie in dit artikel is uitsluitend op eigen risico.
1. Vella S, Schwartländer B, Sow SP, et al. De geschiedenis van antiretrovirale therapie en van de toepassing ervan in gebieden met beperkte middelen in de wereld. AIDS. 2012;26(10):1231-1241.
2. Arts EJ, Hazuda DJ. HIV-1 antiretrovirale geneesmiddelentherapie. Cold Spring Harb Perspect Med. 2012;2(4):a007161.
3. Chaudhuri S, Symons JA, Deval J. Innovation and trends in the development and approval of antiviral medicines: 1987-2017 en verder. Antiviral Res. 2018;155:76-88.
4. Trogarzo (ibalizumab-uiyk) bijsluiter. Montreal, Quebec: Theratechnologies Inc; maart 2018.
5. Pifeltro (doravirine) bijsluiter. Whitehouse Station, NJ: Merck & Co, Inc; maart 2019.
6. Rukobia (fostemsavir) bijsluiter. Research Triangle Park, NC: GlaxoSmithKline; juli 2020.
7. Pan F, Chernew ME, Fendrick AM. Impact of fixed-dose combination drugs on adherence to prescription medications. J Gen Intern Med. 2008;23(5):611-614.
8. Verma AA, Khuu W, Tadrous M,et al. Fixed-dose combination antihypertensive medications, adherence, and clinical outcomes: a population-based retrospective cohort study. PLoS Med. 2018;15(6):e1002584.
9. National Institutes of Health. HIVinfo. FDA-goedgekeurde hiv-medicijnen. hivinfo.nih.gov/understanding-hiv/fact-sheets/fda-approved-hiv-medicines. Accessed September 22, 2020.
10. Prezista (darunavir) bijsluiter. Titusville, NJ: Janssen Therapeutics; mei 2019.
11. Truvada (emtricitabine/tenofovir disoproxil fumaraat) bijsluiter. Foster City, CA: Gilead Sciences, Inc; juni 2004/2020.
12. Delstrigo (doravirine/lamivudine/tenofovir disproxil fumerate) bijsluiter. White House Starion, NJ: Merck & Co, Inc; augustus 2018.
13. Descovy (emtricitabine/tenofovir alafenamide) bijsluiter. Foster City, CA: Gilead Sciences, Inc; december 2019.
14. Tivicay (dolutegravir) bijsluiter. Research Triangle Park, NC. GlaxoSmithKline; juni 2020.
15. Iacob SA, Iacob DG. Ibalizumab gericht tegen CD4-receptoren, een opkomende molecule in HIV-therapie. Front Microbiol. 2017;8:2323.
16. Emu B, Fessel J, Schrader S, et al. Fase 3 studie van ibalizumab voor multidrug-resistente HIV-1. N Engl J Med. 2018;379:645-654.
17. Li Z, Zhou N, Sun Y, et al. Activiteit van de HIV-1-attachmentremmer BMS-626529, het actieve bestanddeel van de prodrug BMS-663068, tegen CD4-onafhankelijke virussen en HIV-1-enveloppen die resistent zijn tegen andere entry-inhibitors. Antimicrob Agents Chemother. 2013:57(9):4172-4180.
18. Kozal M, Aberg J, Pialoux G. Fostemsavir bij volwassenen met een multiresistente hiv-1-infectie. N Engl J Med. 2020;382(13):1232-1243.
19. Cahn P, Fink V, Patterson P. Fostemsavir: a new CD4 attachment inhibitor. Curr Opin HIV AIDS. 2018;13(4):341-345.
20. Biktarvy (bictecgravir/emtricitabine/tenofovir alafenamide) bijsluiter. Foster City, CA: Gilead Sceinces, Inc; februari 2018.
21. Gallant J, Lazzarin A, Mills M, et al. Bictegravir, emtricitabine, en tenofovir alafenamide versus dolutegravir, abacavir, en lamivudine voor de initiële behandeling van hiv-1-infectie (GS-US-380-1489): een dubbelblinde, multicentrische, fase 3, gerandomiseerde gecontroleerde non-inferioriteitsstudie. Lancet. 2017;390(10107):2063-2072.
22. Sax PE, Pozniak A, Montes M, et al. Gecoformuleerd bictegravir, emtricitabine en tenofovir alafenamide versus dolutegravir met emtricitabine en tenofovir alafenamide, voor de initiële behandeling van hiv-1-infectie (GS-US-380-1490): een gerandomiseerde, dubbelblinde, multicentre, fase 3, non-inferiority trial. Lancet. 2017;390(10107):2073-2082.
23. Malina JM, Ward D, Brar I, et al. Switching to fixed-dose bictegravir, emtricitabine, and tenofovir alafenamide from dolutegravir plus abacavir andlamivudine in virologically suppressed adults with HIV-1: 48 weeks results of a randomised, double-blind, multicentre, active-controlled, phase 3, non-inferiority trial. Lancet HIV. 2018;5(7):E357-E365.
24. Daar ES, De Jesus E, Ruane P, et al. Efficacy and safety of switching to fixed-dose bictegravir, emtricitabine, and tenofovir alafenamide from boosted protease inhibitor-based regimens in virologically suppressed adults with HIV-1: 48-week results of a randomised, open-label, multicentre, phase 3, non-inferiority trial. Lancet HIV. 2018;5(7):e347-e356.
25. Dovato (dolutegravir/lamivudine) bijsluiter. Research Triangle Park, NC: GlaxoSmithKline. Maart 2020.
26. Scott LJ. Dolutegravir/lamivudine single-tablet regimen: a review in HIV-1 infection. Drugs. 2020;80(1):61-72.
27. Cahn P, Madero JS, Arribas JR, et al. GEMINI Study Team. Dolutegravir plus lamivudine versus dolutegravir plus tenofovir disoproxil fumaraat en emtricitabine bij antiretroviraal-naïeve volwassenen met HIV-1-infectie (GEMINI-1 en GEMINI-2): week 48 resultaten van twee multicentrische, dubbelblinde, gerandomiseerde, niet-inferioriteits, fase 3-studies. Lancet. 2019;393(10167):143-155.
28. Mayer KH, Molina JM, Thompson MA, et al. Emtricitabine en tenofovir alafenamide vs. emtricitabine en tenofovir disoproxil fumaraat voor HIV pre-exposure profylaxe (DISCOVER): primaire resultaten van een gerandomiseerde, dubbelblinde, multicentrische, actief gecontroleerde, fase 3 niet-inferioriteitsstudie. Lancet. 2020;396(10246):239-254.
29. Hill A, Hughes SL, Gotham D, Pozniak AL. Tenofovir alafenamide versus tenofovir disoproxil fumarate: is er een echt verschil in werkzaamheid en veiligheid? J Virus Erad. 2018;4(2):72-79.