Cele nauczania
- Zidentyfikuj alkany, alkeny, alkiny i związki aromatyczne.
- Wymienić niektóre właściwości węglowodorów.
Najprostsze związki organiczne to takie, które składają się tylko z dwóch pierwiastków: węgla i wodoru. Związki te nazywane są węglowodorami. Same węglowodory dzieli się na dwa rodzaje: węglowodory alifatyczne i węglowodory aromatyczne. Węglowodory alifatyczne to węglowodory zbudowane z łańcuchów atomów C. Istnieją trzy rodzaje węglowodorów alifatycznych. Alkany to węglowodory alifatyczne posiadające tylko pojedyncze wiązania kowalencyjne. Alkeny to węglowodory alifatyczne zawierające co najmniej jedno wiązanie podwójne C-C, a alkeny to węglowodory alifatyczne zawierające wiązanie potrójne C-C. Sporadycznie spotykamy węglowodory alifatyczne z pierścieniem atomów C; węglowodory te nazywamy cykloalkanami (lub cykloalkenami lub cykloalkinami).
Węglowodory aromatyczne, takie jak benzen, są układami płaskich pierścieni, które zawierają stale nakładające się orbitale p. Elektrony w pierścieniu benzenu mają specjalne właściwości energetyczne, które nadają benzenowi właściwości fizyczne i chemiczne, które znacznie różnią się od alkanów. Pierwotnie, termin aromatyczny był używany do opisania tej klasy związków, ponieważ były one szczególnie pachnące. Jednak we współczesnej chemii termin aromatyczny oznacza obecność bardzo stabilnego pierścienia, który nadaje cząsteczce różne i unikalne właściwości.
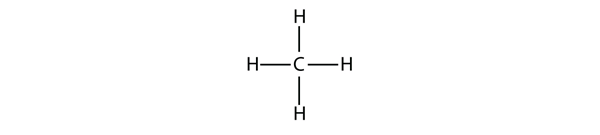
Najprostsze alkany mają atomy C związane w prosty łańcuch; są one nazywane normalnymi alkanami. Są one nazwane w zależności od liczby atomów C w łańcuchu. Najmniejszym alkanem jest metan:
Rysunek 16.1 Trójwymiarowa reprezentacja metanu

Aby utworzyć cztery wiązania kowalencyjne, atom C łączy się z czterema atomami H, tworząc wzór cząsteczkowy metanu CH4. Dwuwymiarowy diagram dla metanu jest jednak mylący; cztery wiązania kowalencyjne, które tworzy atom C, są zorientowane trójwymiarowo w kierunku narożników czworościanu foremnego. Lepsza reprezentacja cząsteczki metanu jest pokazana na Rysunku 16.1 „Trójwymiarowa reprezentacja metanu.”
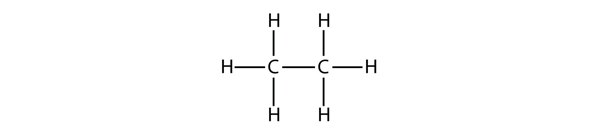
Następny co do wielkości alkan ma dwa atomy C, które są kowalencyjnie połączone ze sobą. Aby każdy atom C mógł utworzyć cztery wiązania kowalencyjne, każdy atom C musi być połączony z trzema atomami H. Powstała w ten sposób cząsteczka, której wzór to C2H6, to etan:
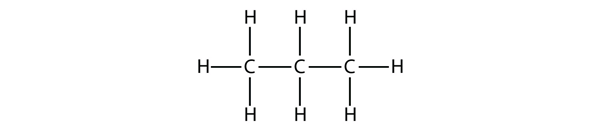
Propan ma szkielet złożony z trzech atomów C otoczonych atomami H. Powinieneś być w stanie sprawdzić, że wzór molekularny propanu to C3H8:
Schematy, które widzieliśmy do tej pory przedstawiające alkany są dość prostymi strukturami Lewisa. Jednak w miarę jak cząsteczki stają się coraz większe, struktury Lewisa stają się coraz bardziej złożone. Jednym ze sposobów obejścia tego problemu jest użycie struktury skondensowanej, która zawiera wzór każdego atomu C w szkielecie cząsteczki. Na przykład, struktura skondensowana dla etanu to CH3CH3, podczas gdy dla propanu jest to CH3CH2CH3. Tabela 16.1 „Pierwsze 10 alkanów” podaje wzory cząsteczkowe, skondensowane wzory strukturalne i nazwy pierwszych 10 alkanów.
Tabela 16.1 The First 10 Alkanes
| Molecular Formula | Condensed Structural Formula | Name |
|---|---|---|
| CH4 | metan | |
| C2H6 | CH3CH3 | etan |
| C3H8 | CH3CH2CH3 | propan |
| C4H10 | CH3CH2CH2CH3 | butan |
| C5H12 | CH3CH2CH2CH3 | pentan |
| C6H14 | CH3(CH2)4CH3 | heksan |
| C7H16 | CH3(CH2)5CH3 | heptan |
| C8H18 | CH3(CH2)6CH3 | oktan |
| C9H20 | CH3(CH2)7CH3 | nonan |
| C10H22 | CH3(CH2)8CH3 | dekan |
Ponieważ alkany mają maksymalną możliwą liczbę atomów H zgodnie z zasadami wiązań kowalencyjnych, alkany są również określane jako węglowodory nasycone.
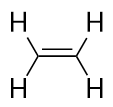
Alkeny mają wiązanie podwójne C-C. Ponieważ mają one mniej niż maksymalną możliwą liczbę atomów H, nazywa się je węglowodorami nienasyconymi. Najmniejszy alken – eten – ma dwa atomy C i jest również znany pod wspólną nazwą etylen:
Następny co do wielkości alken – propen – ma trzy atomy C z podwójnym wiązaniem C-C pomiędzy dwoma atomami C. Znany jest również jako propylen:
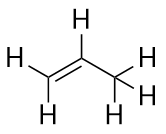
Co zauważyłeś o nazwach alkanów i alkenów? Nazwy alkenów są takie same jak odpowiadających im alkanów, z wyjątkiem tego, że przyrostek (końcówka) to -ene, a nie -ane. Korzystanie z trzonu znany jako łańcuch macierzysty, aby wskazać liczbę atomów C w cząsteczce i zakończenie do reprezentowania rodzaju związku organicznego jest powszechne w chemii organicznej, jak zobaczymy.
Z wprowadzeniem następnego alkenu, butenu, zaczynamy widzieć główny problem z cząsteczek organicznych: wybory. Przy czterech atomach C, podwójne wiązanie C-C może być pomiędzy pierwszym i drugim atomem C lub pomiędzy drugim i trzecim atomem C:
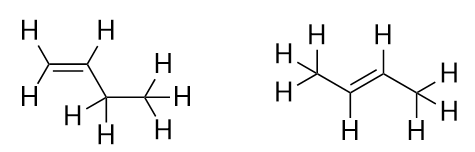
(Wiązanie podwójne pomiędzy trzecim i czwartym atomem C jest takie samo jak pomiędzy pierwszym i drugim atomem C, tylko odwrócone). Zasady nazewnictwa w chemii organicznej wymagają, aby te dwie substancje miały różne nazwy. Pierwsza cząsteczka nazywa się but-1-en, podczas gdy druga cząsteczka nazywa się but-2-en. Liczba pomiędzy nazwą łańcucha macierzystego a przyrostkiem jest znana jako locant i wskazuje, na którym węglu powstało wiązanie podwójne. Najniższa możliwa liczba jest używana do numerowania cech w cząsteczce; dlatego nazywanie drugiej cząsteczki but-3-enem byłoby niepoprawne. Numery są powszechną częścią organicznych nazw chemicznych, ponieważ wskazują, który atom C w łańcuchu zawiera cechę wyróżniającą. Gdy wiązanie podwójne (lub inna grupa funkcyjna) znajduje się na pierwszym atomie węgla, powszechną praktyką niektórych autorów jest pomijanie miejscownika. Na przykład, jeśli buten został napisany bez miejscownika, należy założyć, że odnosi się do but-1-enu, a nie but-2-enu.
Związki but-1-enu i but-2-enu mają różne właściwości fizyczne i chemiczne, mimo że mają ten sam wzór molekularny-C4H8. Różne cząsteczki o tym samym wzorze molekularnym nazywane są izomerami. Izomery są powszechne w chemii organicznej i przyczyniają się do jej złożoności.
Przykład 1
Na podstawie nazw cząsteczek butenu zaproponuj nazwę dla tej cząsteczki.
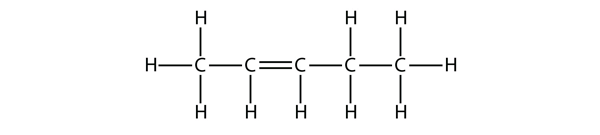
Rozwiązanie
Przy pięciu atomach C użyjemy nazwy penten, a przy podwójnym wiązaniu C-C jest to alken, więc ta cząsteczka jest pentenem. W numeracji atomów C używamy liczby 2, ponieważ jest to najniższe możliwe oznaczenie. Tak więc ta cząsteczka nosi nazwę pent-2-enu.
Sprawdź się
Na podstawie nazw dla cząsteczek butenu zaproponuj nazwę dla tej cząsteczki.
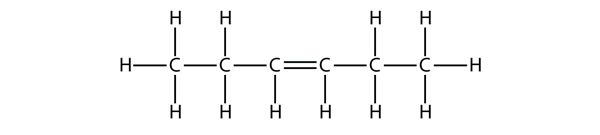
Odpowiedź
hex-3-ene
Alkiny, z wiązaniem potrójnym C-C, są nazywane podobnie jak alkeny, z tym że ich nazwy kończą się na -yne. Najmniejszym alkenem jest etyn, który znany jest również jako acetylen:
![]()
Propyne ma taką strukturę:
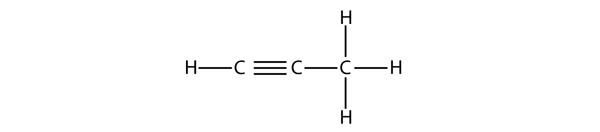
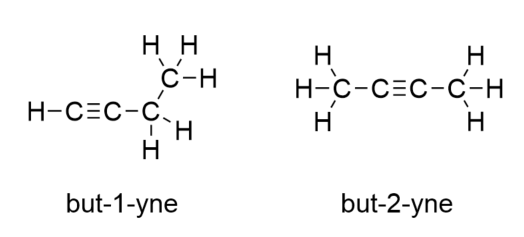
W przypadku butyny musimy zacząć numerować położenie wiązania potrójnego, tak jak to robiliśmy z alkenami:
Benzen jest związkiem aromatycznym zbudowanym z sześciu atomów C w pierścieniu, z naprzemiennie występującymi pojedynczymi i podwójnymi wiązaniami C-C:
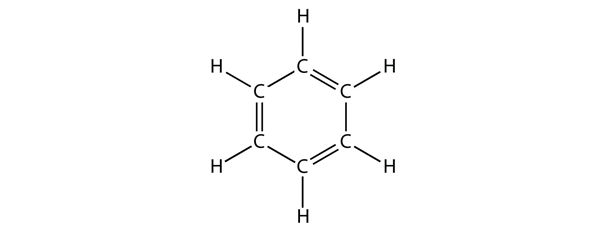
Naprzemienne pojedyncze i podwójne wiązania C-C nadają pierścieniowi benzenu szczególną stabilność i nie reaguje on jak alken, jak można by się spodziewać.
Jakkolwiek węglowodory mają fundamentalne znaczenie dla chemii organicznej, ich właściwości i reakcje chemiczne są raczej prozaiczne. Większość węglowodorów jest niepolarna ze względu na bliską elektronegatywność atomów C i H. Jako takie, rozpuszczają się one w H2O i innych rozpuszczalnikach polarnych tylko w niewielkim stopniu. Małe węglowodory, takie jak metan i etan, są w temperaturze pokojowej gazami, podczas gdy większe węglowodory, takie jak heksan i oktan, są cieczami. Jeszcze większe węglowodory, takie jak hentriakontan (C31H64), są ciałami stałymi w temperaturze pokojowej i mają miękką, woskową konsystencję.
Węglowodory są raczej niereaktywne, ale uczestniczą w niektórych klasycznych reakcjach chemicznych. Jedną z często spotykanych reakcji jest podstawienie atomu halogenu poprzez połączenie węglowodoru z halogenem pierwiastkowym. Światło jest czasami używane do promowania reakcji, tak jak w przypadku reakcji pomiędzy metanem i chlorem:
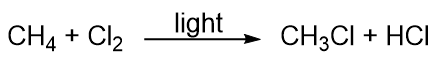
Halogeny mogą również reagować z alkenami i alkinami, ale reakcja jest inna. W tych przypadkach cząsteczki halogenu reagują z podwójnym lub potrójnym wiązaniem C-C i przyłączają się do każdego atomu C zaangażowanego w wiązania wielokrotne. Reakcja ta nazywana jest reakcją addycji. Jednym z przykładów jest
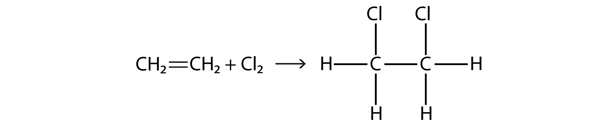
Warunki reakcji są zazwyczaj łagodne; w wielu przypadkach halogen reaguje spontanicznie z alkenem lub alkinem.
Wodór może być również dodawany przez wiązanie wielokrotne; reakcja ta jest nazywana reakcją uwodornienia. W tym przypadku jednak, warunki reakcji nie mogą być łagodne; konieczne może być zastosowanie wysokich ciśnień gazu H2. Zwykle stosuje się katalizator platynowy lub palladowy, aby reakcja przebiegała w rozsądnym tempie:
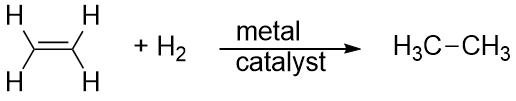
Zdecydowanie najczęstszą reakcją węglowodorów jest spalanie, które polega na połączeniu węglowodoru z O2 w celu wytworzenia CO2 i H2O. Spalaniu węglowodorów towarzyszy uwalnianie energii i jest ono podstawowym źródłem produkcji energii w naszym społeczeństwie (Rysunek 16.2 „Spalanie”). Na przykład reakcja spalania benzyny, którą można przedstawić jako C8H18, przebiega następująco:
2 C8H18 + 25 O2 → 16 CO2 + 18 H2O + ~5060 kJ
Rysunek 16.2 Spalanie

.