Patofizjologia VIVO
Struktura insuliny
Insulina składa się z dwóch łańcuchów peptydowych określanych jako łańcuch A i łańcuch B. Łańcuchy A i B są połączone ze sobą dwoma wiązaniami disulfidowymi, a dodatkowy disulfid powstaje w obrębie łańcucha A. U większości gatunków łańcuch A składa się z 21 aminokwasów, a łańcuch B z 30 aminokwasów.
Choć sekwencja aminokwasowa insuliny różni się u poszczególnych gatunków, niektóre segmenty cząsteczki są wysoce konserwowane, w tym pozycje trzech wiązań disulfidowych, oba końce łańcucha A i reszty C-końcowe łańcucha B. Te podobieństwa w sekwencji aminokwasowej insuliny prowadzą do trójwymiarowej konformacji insuliny, która jest bardzo podobna u różnych gatunków, a insulina pochodząca od jednego zwierzęcia jest z dużym prawdopodobieństwem biologicznie aktywna u innych gatunków. Rzeczywiście, insulina świńska była szeroko stosowana w leczeniu pacjentów ludzkich.
Cząsteczki insuliny mają tendencję do tworzenia dimerów w roztworze z powodu wiązań wodorowych pomiędzy C-końcami łańcuchów B. Dodatkowo, w obecności jonów cynku, dimery insuliny łączą się w heksamery.
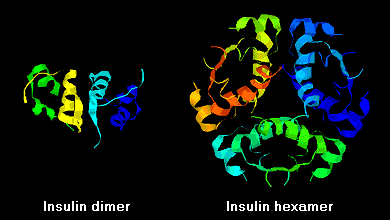
Interakcje te mają istotne znaczenie kliniczne. Monomery i dimery łatwo dyfundują do krwi, natomiast heksamery dyfundują słabo. W związku z tym wchłanianie preparatów insuliny zawierających duży udział heksamerów jest opóźnione i nieco powolne. Zjawisko to, między innymi, stało się bodźcem do opracowania szeregu rekombinowanych analogów insuliny. Pierwsza z tych cząsteczek wprowadzona na rynek – o nazwie insulina lispro – jest tak skonstruowana, że reszty lizynowe i prolinowe na C-końcowym końcu łańcucha B są odwrócone; modyfikacja ta nie zmienia wiązania z receptorem, ale minimalizuje tendencję do tworzenia dimerów i heksamerów.
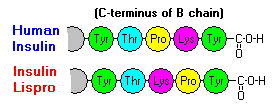 .
.