Este artigo, o terceiro de uma série de quatro partes, descreve o procedimento para colher uma amostra fecal de um paciente com diarreia
Citação: Shepherd E (2017) Espécimen collection 3: espécime fecal de um paciente com diarréia. Tempos de Enfermagem; 113: 8, 27-29.
Autor: Eileen Shepherd é editora clínica no Nursing Times.
- Este artigo foi revisto por pares duplo-cego
- Rolo para baixo para ler o artigo ou fazer o download de um PDF com facilidade de impressão aqui
- Clique aqui para ver outros artigos desta série
Introdução
Obter uma amostra envolve a recolha de tecido ou fluidos para análise laboratorial ou testes próximos aos pacientes, e pode ser um primeiro passo na determinação de um diagnóstico e tratamento (Dougherty and Lister, 2015). Os espécimes devem ser coletados no momento certo usando a técnica e o equipamento corretos e entregues ao laboratório em tempo hábil (Dougherty and Lister, 2015). A caixa 1 fornece um lembrete dos princípios gerais de coleta de espécimes, que foram discutidos com mais detalhes na parte 1 (Shepherd, 2017).
Box 1. Princípios de coleta de espécimes
O espécime deve ser:
- Apropriado à apresentação clínica do paciente
- Colhido no momento certo
- Colhido de uma forma que minimize a contaminação
- Colhido de uma forma que reduza o risco para a saúde e segurança a todo o pessoal que manuseia a amostra (incluindo o pessoal do laboratório)
- Colhida usando o equipamento correcto
- Documentada claramente usando formulários apropriados
- Armazenada/transportada apropriadamente
Fonte: Higgins, 2008
Diarreia
Diarreia é definida como uma frequência invulgar de acção intestinal (pelo menos três vezes num período de 24 horas) com fezes soltas, aquosas e não formadas (Public Health England, 2014). As fezes formadas frequentemente não são consideradas diarreia – a consistência das fezes é mais importante que a frequência; os doentes com diarreia podem também queixar-se de sintomas como cólicas abdominais, náuseas, vómitos e febre (PHE, 2014). A perda excessiva de líquidos pode resultar em desidratação, particularmente em bebés, crianças e pessoas idosas. O volume de diarréia deve ser registrado como parte do equilíbrio hídrico e os pacientes com diarréia devem ser avaliados regularmente para quaisquer sinais de desidratação.
A causa da diarréia infecciosa precisa ser identificada para que o manejo e o tratamento adequados possam ser implementados. Isto ajuda a prevenir a propagação da infecção através de precauções apropriadas de prevenção da infecção, tais como isolamento e descontaminação ambiental (Dougherty and Lister, 2015).
Em episódios de diarreia aguda, as medidas de prevenção e controlo da infecção devem ser implementadas sem esperar pelos resultados da amostra (Department of Health (DH), 2012). Estas incluem:
- Lavagem eficaz das mãos com água e sabão (as bebidas alcoólicas são ineficazes contra o Clostridium difficile (C difficile) e não devem ser utilizadas no manuseamento de fezes potencialmente infectadas) (DH, 2012);
- Isolamento ou enfermagem de coorte;
- Utilizar luvas e aventais não esterilizados no manuseamento de fezes.
É importante explicar quaisquer precauções aos pacientes e seus familiares, e mantê-los actualizados com os resultados laboratoriais. Informações escritas podem ser úteis para mantê-los informados sobre os fundamentos dos seus cuidados e o seu papel na prevenção da propagação da infecção (Dougherty and Lister, 2015).
Espécimes Faecais
Espécimes Faecais são geralmente obtidos para exame microbiológico para identificar organismos patogênicos que causam infecções gastrointestinais, tais como bactérias, vírus e parasitas (Dougherty e Lister, 2015) (Caixa 2).
Box 2. Agentes infecciosos que requerem uma amostra fecal
Bacteria:
- Salmonella
- Campylobacter
- Helicobacter
- Shigella
- Escherichia coli
- Clostridium difficile
Viral:
- Norovírus
- Rotovírus
Parasitas:
- Protozoa
- Tapeworm
- Entamoeba
Source: Dougherty and Lister, 2015
Indicações para recolher uma amostra fecal são mostradas na caixa 3.
Box 3. Indicações para recolher uma amostra fecal
- Investigue a suspeita de diarreia infecciosa em pacientes que estejam sistematicamente indispostos com sintomas de diarreia, vómitos, dor, perda de peso e febre
- Identificar a causa da diarréia causada após viagens ao exterior
- Identificar parasitas suspeitos, como ténias
- Investigar a diarréia associada ao uso de antibióticos
- Contatos sintomáticos de pacientes com infecção associada a organismos como a Escherichia coli 0157, onde a infecção tem consequências graves (FHE, 2014)
- Identificar sangue oculto nas fezes (isto requer um procedimento diferente)
>
>
Fonte: adaptado de Dougherty and Lister, 2015
A recolha de uma amostra fecal deve ser considerada como parte de uma avaliação holística de enfermagem, e os pacientes com diarreia devem ser avaliados para sintomas associados de febre, vómitos e dor abdominal. É importante registrar qualquer tratamento antibiótico recente, viagens ao exterior ou preocupações com intoxicações alimentares que possam explicar a diarréia e influenciar os testes laboratoriais necessários.
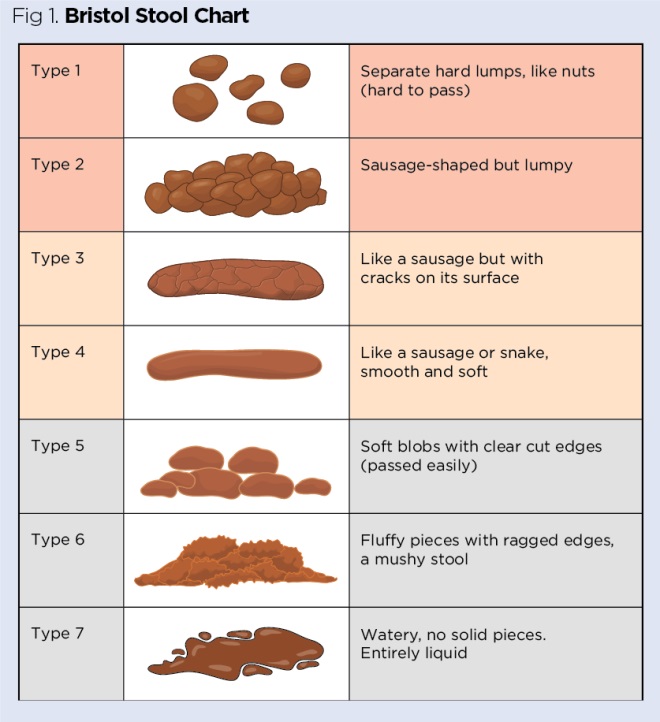
A cor e consistência das fezes devem ser registradas juntamente com a presença de sangue. A consistência das fezes pode ser classificada usando um sistema padronizado como o Bristol Stool Chart (Fig 1) (Lewis e Heaton, 1997), no qual a diarreia é geralmente classificada como fezes tipo 6 ou 7. Quando há uma suspeita de C difficile (todos os pacientes no hospital, pacientes comunitários com mais de 65 anos), as fezes dos tipos 5, 6 e 7 devem ser consideradas como diarreia e enviadas para teste, a menos que a diarreia seja claramente atribuível a uma condição subjacente, como colite ou transbordamento ou a uma terapia como laxantes ou alimentação enteral (DH, 2012).
A cor das fezes pode ser influenciada pela dieta, mas também pode indicar um problema de saúde subjacente. Por exemplo, uma fezes negras pode ocorrer como um efeito secundário da terapia com ferro oral mas também pode indicar hemorragia do tracto gastrointestinal superior.
Sugere-se que o odor das fezes seja registado, pois ajuda a construir um quadro clínico da doença (Dougherty and Lister, 2015); por exemplo, infecções como o C difficile produzem fezes com um odor distintamente desagradável. No entanto, a capacidade dos enfermeiros para identificar esta infecção com base apenas no cheiro foi questionada (Krishna et al, 2013). Os profissionais de saúde não devem ser encorajados a cheirar intencionalmente as fezes, pois isso poderia aumentar o risco de inalação de organismos fecais.
Uma amostra deve ser coletada dentro de 48 horas após o início dos sintomas, pois a chance de identificar o patógeno diminui uma vez passada a fase aguda da doença (Dougherty e Lister, 2014). Quando há suspeita de C difficile – particularmente em pacientes hospitalizados – uma amostra deve ser obtida ao primeiro sinal de diarreia, em vez de esperar que ocorram episódios subsequentes de diarreia (DH, 2012). Os espécimes devem ser colhidos antes da prescrição de terapia antimicrobiana (PHE, 2014).
Colher uma amostra fecal
A técnica limpa deve ser usada para colher a amostra de fezes para evitar contaminação, o que pode resultar em tratamento inadequado (Dougherty and Lister, 2015). Alguns pacientes podem ser capazes de recolher a sua própria amostra, mas é importante explicar claramente os passos, enfatizar a necessidade de uma boa higiene das mãos e explicar como evitar a contaminação da amostra. Embora a contaminação com urina deva ser evitada sempre que possível, as amostras fecais ainda podem ser processadas pelo laboratório se a urina estiver presente.
Equipamento
- Clean bed pan ou receptor descartável – certifique-se de que a arrastadeira não está contaminada com detergente ou desinfectante, pois isto pode afectar os resultados (PHE, 2014);
- Bandeja para transporte de equipamento;
- Pote de amostras estéril com colher integral;
- Luvas não estéreis;
- Apron;
- Forma de espécimen e saco de amostras.
>
>
>
>
O procedimento
Discutir o procedimento com o paciente, explicando porque é que a amostra está a ser recolhida e quando é que os resultados são esperados. Obtenha o consentimento informado válido e documente-o nas notas do paciente (Nursing and Midwifery Council, 2015).
- Cuidado com a privacidade e dignidade, pois os pacientes podem achar o procedimento embaraçoso.
- Lave as mãos com água e sabão (ainda sem risco de infecção cruzada) e monte o equipamento.
- Coloque luvas não esterilizadas e avental para reduzir o risco de infecção cruzada.
- Coloque a urina no paciente antes de recolher a amostra de fezes – isto evita que a urina se misture com fezes e contamine a amostra (PHE, 2014).
- Coloque a urina no paciente para defecar na arrastadeira ou receptor.
- Se o paciente estiver incontinente, uma amostra pode ser retirada da roupa de cama mas deve ser evitada a contaminação com urina (Dougherty and Lister, 2015).
- Utilizar a colher integral no vaso de amostras para recolher fezes suficientes para encher cerca de um quarto do vaso de amostras (DH 2012)
- (Fig 2a). As fezes devem ser líquidas ou semi-formadas e assumir a forma do recipiente (PHE, 2014) (Fig 2b).
- Se forem vistos segmentos de ténia, envie-os para o laboratório. Os segmentos de ténia podem variar desde o tamanho dos grãos de arroz até uma fita (Brekle, 2014).
- Segurar a parte superior do recipiente – isto evitará fugas.
- Remover luvas e avental e eliminá-los.
- lavar as mãos com água e sabão para reduzir o risco de infecção cruzada. As hidratos de álcool são ineficazes contra C difficile e não devem ser utilizadas no manuseamento de fezes potencialmente infectadas (DH, 2012) (Fig 2c).
- Examinar a amostra e registar a cor, consistência e odor das fezes como parte da avaliação de enfermagem.
- Etiquete a amostra e preencha o formulário microbiológico incluindo quaisquer factores, tais como tratamento antibiótico recente, viagens ao estrangeiro e suspeita de intoxicação alimentar – isto ajudará com testes laboratoriais precisos.
- Coloque a amostra numa bolsa de amostras.
- Envie a amostra para o laboratório o mais depressa possível. Patógenos infecciosos, como as espécies shigella e entamoeba, só sobrevivem por um curto período fora do corpo (Brekle, 2014; PHE, 2014). É importante verificar a política local para mais informações sobre transporte e armazenamento, caso haja suspeita destas infecções. Se houver um atraso no transporte, as amostras podem ser refrigeradas mas devem ser processadas dentro de 12 horas (PHE, 2014).
- Documentar o procedimento nas notas do paciente.
>

Responsabilidades profissionais
Este procedimento deve ser realizado somente após treinamento aprovado, prática supervisionada e avaliação de competência, e realizado de acordo com as políticas e protocolos locais.
Departamento de Saúde (2012) Clostridium Difficile Upficile Guidance on the Diagnosis and Reporting.
Dougherty L, Lister S (2015) The Royal Marsden Hospital Manual of Clinical Nursing Procedures. Oxford: Blackwell.
Krishna R et al (2013) The nose knows not: poor predictive value of stool sample odor for detection of Clostridium difficile. Doenças Infecciosas Clínicas; 56: 4, 615-616.
Higgins D (2008) Colheita de espécimes 1: obtenção de uma amostra de urina a meio do fluxo. Nursing Times; 104: 17, 26-27.
Lewis SJ, Heaton KW (1997) Escala de forma de fezes como um guia útil para o tempo de trânsito intestinal. Scandinavian Journal of Gastroenterology; 32: 920-924.
Nursing and Midwifery Council (2015) The Code. Professional Standards of Practice and Behaviour for Nurses and Midwives.
Public Health England (2014) UK Standards for Microbiology Investigations Investigation of Faecal Specimens for Enteric Pathogens.
Shepherd E (2017) Specimen collection 1: general principles and procedure for obtaining a midstream urine specimen. Tempo de amamentação; 113: 7, 45-47.