Cet article, le troisième d’une série de quatre, décrit la procédure de collecte d’un spécimen fécal d’un patient atteint de diarrhée
Citation : Shepherd E (2017) Collecte de spécimen 3 : spécimen fécal d’un patient atteint de diarrhée. Nursing Times ; 113 : 8, 27-29.
Auteur : Eileen Shepherd est rédactrice clinique à Nursing Times.
- Cet article a fait l’objet d’un examen par les pairs en double aveugle
- Défilez vers le bas pour lire l’article ou téléchargez un PDF imprimable ici
- Cliquez ici pour voir d’autres articles de cette série
Introduction
L’obtention d’un spécimen implique la collecte de tissus ou de fluides pour une analyse de laboratoire ou un test proche du patient, et peut constituer une première étape dans la détermination d’un diagnostic et d’un traitement (Dougherty et Lister, 2015). Les échantillons doivent être collectés au bon moment en utilisant la technique et l’équipement adéquats, et être livrés au laboratoire en temps voulu (Dougherty et Lister, 2015). L’encadré 1 rappelle les principes généraux de la collecte des spécimens, qui ont été abordés plus en détail dans la première partie (Shepherd, 2017).
Boîte 1. Principes de collecte des spécimens
Le spécimen doit être :
- Adapté à la présentation clinique du patient
- Collecté au bon moment
- Collecté de manière à minimiser la contamination
- Collecté de manière à réduire les risques pour la santé et la sécurité. pour tout le personnel manipulant l’échantillon (y compris le personnel de laboratoire)
- Collecté en utilisant l’équipement correct
- Documenté clairement en utilisant les formulaires appropriés
- Stocké/transporté de manière appropriée
Source : Higgins, 2008
Diarrhée
La diarrhée est définie comme une fréquence inhabituelle de défécation (au moins trois fois sur une période de 24 heures) avec des selles molles, aqueuses et non formées (Public Health England, 2014). Des selles formées fréquentes ne sont pas considérées comme de la diarrhée – la consistance des selles est plus importante que la fréquence ; les patients atteints de diarrhée peuvent également se plaindre de symptômes tels que des crampes abdominales, des nausées, des vomissements et de la fièvre (PHE, 2014). Une perte excessive de liquide peut entraîner une déshydratation, en particulier chez les bébés, les enfants et les personnes âgées. Le volume de la diarrhée doit être enregistré dans le cadre de l’équilibre hydrique et les patients atteints de diarrhée doivent être évalués régulièrement pour détecter tout signe de déshydratation.
La cause de la diarrhée infectieuse doit être identifiée afin qu’une prise en charge et un traitement appropriés puissent être mis en œuvre. Cela permet d’éviter la propagation de l’infection grâce à des précautions appropriées de prévention de l’infection, telles que l’isolement et la décontamination de l’environnement (Dougherty et Lister, 2015).
Dans les épisodes de diarrhée aiguë, des mesures de prévention et de contrôle de l’infection doivent être mises en place sans attendre les résultats de l’échantillon (Department of Health (DH), 2012). Ces mesures comprennent :
- Un lavage des mains efficace à l’eau et au savon (les désinfectants pour les mains à base d’alcool sont inefficaces contre Clostridium difficile (C difficile) et ne devraient pas être utilisés lors de la manipulation de selles potentiellement infectées) (DH, 2012);
- Isolation ou soins infirmiers en cohorte;
- Utilisation de gants et de tabliers non stériles lors de la manipulation de selles.
Il est important d’expliquer toute précaution aux patients et à leurs proches, et de les tenir au courant des résultats de laboratoire. Des informations écrites peuvent être utiles pour les tenir informés de la justification de leurs soins et de leur rôle dans la prévention de la propagation de l’infection (Dougherty et Lister, 2015).
Échantillons fécaux
Les échantillons fécaux sont généralement obtenus pour un examen microbiologique visant à identifier les organismes pathogènes qui causent des infections gastro-intestinales, tels que les bactéries, les virus et les parasites (Dougherty et Lister, 2015) (encadré 2).
Boîte 2. Agents infectieux nécessitant un échantillon fécal
Bactérien:
- Salmonella
- Campylobacter
- Helicobacter
- Shigella
- Escherichia coli
- Clostridium difficile
Viral :
- Norovirus
- Rotovirus
Parasites:
- Protozoaires
- Tapeworm
- Entamoeba
Source : Dougherty et Lister, 2015
Les indications pour la collecte d’un échantillon fécal sont présentées dans l’encadré 3.
Encadré 3. Indications pour le prélèvement d’un échantillon fécal
- Investiguer une suspicion de diarrhée infectieuse chez les patients qui sont systématiquement mal en point avec des symptômes de diarrhée, vomissements, douleurs, perte de poids et fièvre
- Identifier la cause de la diarrhée causée après un voyage à l’étranger
- Identifier les parasites suspectés tels que les ténias
- Investiguer la diarrhée associée à l’utilisation d’antibiotiques
- Dépister les contacts symptomatiques des patients atteints d’une infection associée à des organismes tels que Escherichia coli 0157 lorsque l’infection a des conséquences graves (PHE, 2014)
- Identifier le sang occulte dans les selles (cela nécessite une procédure différente)
Source : adapté de Dougherty et Lister, 2015
La collecte d’un échantillon fécal doit être envisagée dans le cadre d’une évaluation infirmière holistique, et les patients atteints de diarrhée doivent être évalués pour les symptômes associés de fièvre, de vomissements et de douleurs abdominales. Il est important de noter tout traitement antibiotique récent, tout voyage à l’étranger ou toute préoccupation concernant une intoxication alimentaire qui pourrait expliquer la diarrhée et influencer les tests de laboratoire nécessaires.
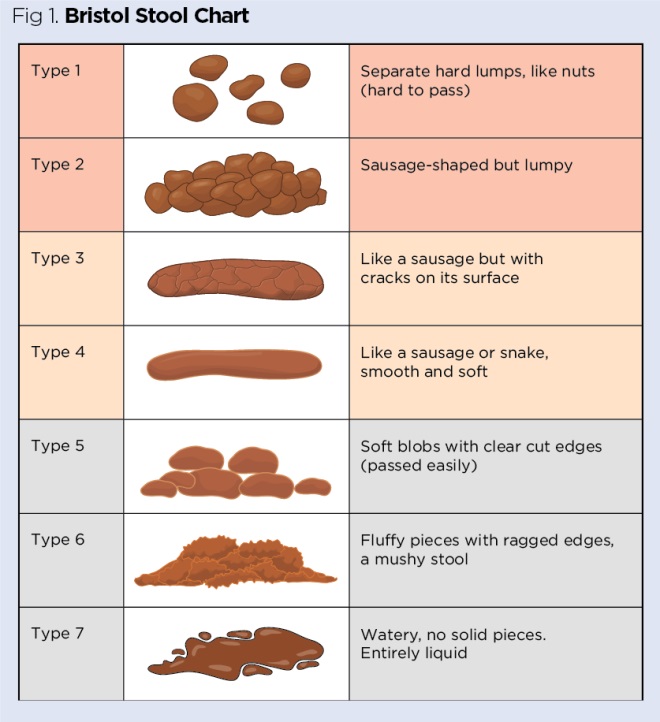
La couleur et la consistance des selles doivent être notées ainsi que la présence de sang. La consistance des selles peut être classée à l’aide d’un système standardisé tel que le Bristol Stool Chart (Fig 1) (Lewis et Heaton, 1997), sur lequel la diarrhée est généralement classée dans le type de selles 6 ou 7. En cas de suspicion de C difficile (tous les patients hospitalisés, les patients communautaires de plus de 65 ans), les types de selles 5, 6 et 7 doivent être considérés comme des diarrhées et envoyés pour être testés, à moins que la diarrhée ne soit clairement attribuable à une affection sous-jacente telle qu’une colite ou un débordement ou à un traitement tel que des laxatifs ou une alimentation entérale (DH, 2012).
La couleur des selles peut être influencée par le régime alimentaire mais peut également indiquer un problème de santé sous-jacent. Par exemple, des selles noires peuvent survenir en tant qu’effet secondaire d’une thérapie orale à base de fer, mais peuvent également indiquer des saignements du tractus gastro-intestinal supérieur.
Il est suggéré que l’odeur des selles soit enregistrée car cela aide à construire un tableau clinique de la condition (Dougherty et Lister, 2015) ; par exemple, des infections telles que le C difficile produisent des selles avec une odeur fétide distinctive. Cependant, la capacité des infirmières à identifier cette infection sur la seule base de l’odeur a été remise en question (Krishna et al, 2013). Les travailleurs de la santé ne devraient pas être encouragés à sentir intentionnellement les matières fécales, car cela pourrait augmenter le risque d’inhalation d’organismes fécaux.
Un échantillon devrait être collecté dans les 48 heures suivant l’apparition des symptômes, car les chances d’identifier l’agent pathogène diminuent une fois la phase aiguë de la maladie passée (Dougherty et Lister, 2014). En cas de suspicion de C difficile – en particulier chez les patients hospitalisés – un échantillon doit être obtenu au premier signe de diarrhée plutôt que d’attendre l’apparition d’épisodes ultérieurs de diarrhée (DH, 2012). Les spécimens devraient être collectés avant la prescription d’une thérapie antimicrobienne (PHE, 2014).
Collecter un spécimen fécal
Une technique propre doit être utilisée pour collecter l’échantillon de selles afin d’éviter toute contamination, ce qui peut entraîner un traitement inapproprié (Dougherty et Lister, 2015). Certains patients peuvent être en mesure de recueillir leur propre échantillon, mais il est important d’expliquer clairement les étapes, d’insister sur la nécessité d’une bonne hygiène des mains et d’expliquer comment éviter de contaminer l’échantillon. Bien que la contamination par l’urine doive être évitée dans la mesure du possible, les échantillons fécaux peuvent toujours être traités par le laboratoire en cas de présence d’urine.
Équipement
- Nettoyer le bassin de lit ou le récepteur jetable – s’assurer que le bassin de lit n’est pas contaminé par du détergent ou du désinfectant car cela peut affecter les résultats (PHE, 2014) ;
- Tableau à pulpe pour transporter le matériel;
- Pot à spécimen stérile avec une cuillère intégrée;
- Gants non stériles;
- Apron;
- Formulaire et sac à spécimen.
La procédure
Discutez de la procédure avec le patient, en expliquant pourquoi le prélèvement est effectué et quand les résultats sont attendus. Obtenez un consentement éclairé valide et documentez-le dans les notes du patient (Nursing and Midwifery Council, 2015).
- Assurez l’intimité et la dignité car les patients peuvent trouver la procédure embarrassante.
- Lavez-vous les mains avec de l’eau et du savon (pas encore de risque d’infection croisée) et assemblez le matériel.
- Mettez des gants et un tablier non stériles pour réduire le risque d’infection croisée.
- Demander au patient d’uriner avant de prélever l’échantillon de selles – cela évite que l’urine ne se mélange aux matières fécales et ne contamine l’échantillon (PHE, 2014).
- Demander au patient de déféquer dans le bassin ou le récepteur.
- Si le patient est incontinent, un échantillon peut être prélevé sur le linge de lit mais la contamination par l’urine doit être évitée (Dougherty et Lister, 2015).
- Utiliser la cuillère intégrale du pot d’échantillon pour recueillir suffisamment de matières fécales pour remplir environ un quart du pot d’échantillon (DH 2012)
- (Fig 2a). Les fèces doivent être liquides ou semi-formées et prendre la forme du récipient (PHE, 2014) (Fig 2b).
- Si des segments de ténia sont vus, envoyez-les au laboratoire. Les segments de ténia peuvent varier de la taille d’un grain de riz à celle d’un ruban (Brekle, 2014).
- Sécurisez le haut du récipient – cela empêchera les fuites.
- Retirez les gants et le tablier et jetez-les.
- Lavez-vous les mains avec de l’eau et du savon pour réduire le risque d’infection croisée. Les gommages à base d’alcool sont inefficaces contre le C difficile et ne doivent pas être utilisés lors de la manipulation de selles potentiellement infectées (DH, 2012) (Fig 2c).
- Examiner le spécimen et noter la couleur, la consistance et l’odeur des selles dans le cadre de l’évaluation infirmière.
- Étiqueter l’échantillon et remplir le formulaire de microbiologie en incluant tout facteur tel qu’un traitement antibiotique récent, un voyage à l’étranger et une suspicion d’intoxication alimentaire – cela aidera à la précision des tests de laboratoire.
- Mettre l’échantillon dans un sac à échantillons.
- Envoyer l’échantillon au laboratoire dès que possible. Les agents pathogènes infectieux tels que les espèces de shigella et d’entamoeba ne survivent que peu de temps en dehors du corps (Brekle, 2014 ; PHE, 2014). Il est important de vérifier la politique locale pour plus d’informations sur le transport et le stockage si ces infections sont suspectées. S’il y a un retard dans le transport, les spécimens peuvent être réfrigérés mais ils doivent être traités dans les 12 heures (PHE, 2014).
- Documenter la procédure dans les notes du patient.

Responsabilités professionnelles
Cette procédure ne doit être entreprise qu’après une formation approuvée, une pratique supervisée et une évaluation des compétences, et réalisée conformément aux politiques et protocoles locaux.
Department of Health (2012) Clostridium Difficile Updated Guidance on the Diagnosis and Reporting.
Dougherty L, Lister S (2015) The Royal Marsden Hospital Manual of Clinical Nursing Procedures. Oxford : Blackwell.
Krishna R et al (2013) The nose knows not : poor predictive value of stool sample odor for detection of Clostridium difficile. Clinical Infectious Diseases ; 56 : 4, 615-616.
Higgins D (2008) Prélèvement d’échantillons 1 : obtention d’un échantillon d’urine à mi-course. Nursing Times ; 104 : 17, 26-27.
Lewis SJ, Heaton KW (1997) Stool form scale as a useful guide to intestinal transit time. Scandinavian Journal of Gastroenterology ; 32 : 920-924.
Nursing and Midwifery Council (2015) The Code. Normes professionnelles de pratique et de comportement pour les infirmières et les sages-femmes.
Public Health England (2014) Normes britanniques pour les investigations microbiologiques Investigation des échantillons fécaux pour les pathogènes entériques.
Shepherd E (2017) Collecte d’échantillons 1 : principes généraux et procédure pour obtenir un échantillon d’urine à mi-courant. Nursing Times ; 113 : 7, 45-47.