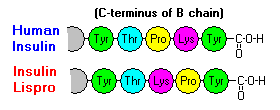VIVO Patofysiologi
Insulinets struktur
Insulin består av två peptidkedjor som kallas A-kedjan och B-kedjan. A- och B-kedjorna är sammanlänkade med två disulfidbindningar, och ytterligare en disulfid bildas inom A-kedjan. Hos de flesta arter består A-kedjan av 21 aminosyror och B-kedjan av 30 aminosyror.
Och även om insulinets aminosyrasekvens varierar mellan olika arter är vissa segment av molekylen mycket konserverade, inklusive positionerna för de tre disulfidbindningarna, A-kedjans båda ändar och de C-terminala resterna av B-kedjan. Dessa likheter i insulinets aminosyrasekvens leder till en tredimensionell konformation av insulin som är mycket likartad mellan olika arter, och insulin från ett djur är med stor sannolikhet biologiskt aktivt i andra arter. Grisinsulin har faktiskt använts i stor utsträckning för att behandla mänskliga patienter.
Insulinmolekyler har en tendens att bilda dimerer i lösning på grund av vätebindning mellan B-kedjornas C-terminaler. I närvaro av zinkjoner associeras dessutom insulindimerer till hexamerer.
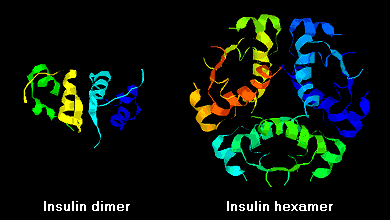
Dessa interaktioner har viktiga kliniska förgreningar. Monomerer och dimerer diffunderar lätt i blodet, medan hexamerer diffunderar dåligt. Därför är absorptionen av insulinpreparat som innehåller en hög andel hexamerer fördröjd och något långsam. Bland annat detta fenomen har stimulerat utvecklingen av ett antal rekombinanta insulinanaloger. Den första av dessa molekyler som marknadsförs – kallad insulin lispro – är konstruerad så att lysin- och prolinrester på B-kedjans C-terminala ände är omvända; denna modifiering förändrar inte receptorbindningen, men minimerar tendensen att bilda dimerer och hexamerer.