

John Daltons atomteori lade grunden för den moderna kemin.
John Daltons tidiga liv och utbildning
John Dalton föddes den 6 september 1766 i Eaglesfield, England, Storbritannien.
Båda hans föräldrar var kväkare. Även om kväkare var kristna sågs de som oliktänkande av den etablerade engelska kyrkan. Som ett resultat av detta var John Daltons högre utbildningsmöjligheter begränsade till de oliktänkande utbildningsorterna.
Hans far var en vävare som ägde ett hus och en liten mängd mark.
John Dalton var ett intelligent barn som intresserade sig för världen omkring honom och försökte lära sig så mycket som möjligt om allting.
Han gick i sin byskola tills han var 11 år och började sedan hjälpa till som lärare.
Vid 15 års ålder började han hjälpa sin äldre bror John att driva en kväkarnas internatskola i staden Kendal, 40 mil från hans hem. Hela tiden fortsatte han att lära sig själv naturvetenskap, matematik, latin, grekiska och franska. När han var 19 år gammal hade han blivit skolans rektor och fortsatte i den rollen tills han var 26 år gammal.
Det verkar som om skolans elever tyckte om att bli undervisade av Dalton, en av dem minns:
”Pojkarna (var) alla glada över att undervisas av John Dalton, eftersom han hade ett mildare sinnelag; och dessutom var hans sinne så upptaget av matematik, att deras fel undgick hans uppmärksamhet.”
Becoming a Scientist
Under första halvan av 1793, 26 år gammal, tog Dalton anställning som lärare i matematik och naturfilosofi vid New College i Manchester, ett dissidentkollegium.”
År 1794 skrev han sin första vetenskapliga uppsats som han kallade: Extraordinary Facts Relating to the Vision of Colours.
Detta var den första uppsatsen någonsin som diskuterade färgblindhet. Dalton hade insett att tillståndet var ärftligt eftersom han och andra medlemmar i hans familj hade det. I slutändan var Daltons teori om färgblindhet felaktig, men eftersom han var den första personen någonsin att forska om det blev tillståndet känt som daltonism.
Efter detta publicerade han fler forskningsartiklar inom fysikaliska vetenskaper där han undersökte värmeledning, gasexpansion genom värme, ljusets egenskaper, norrskenet och meteorologi.
År 1800 avgick Dalton från New College, som befann sig i ekonomiska svårigheter, och började arbeta som privatlärare i naturvetenskap och matematik.
Atomteori
Gasers beteende
År 1801 höll Dalton en serie föreläsningar i Manchester vars innehåll publicerades 1802. I dessa föreläsningar presenterade han forskning som han hade bedrivit om gaser och vätskor. Denna forskning var banbrytande och gav stora nya insikter om gasernas natur.
För det första konstaterade Dalton korrekt att han inte tvivlade på att alla gaser kunde göras flytande förutsatt att deras temperatur var tillräckligt låg och trycket tillräckligt högt.
Därefter konstaterade han att när dess volym hålls konstant i en behållare varierar trycket hos en gas i direkt proportion till dess temperatur.
Detta var det första offentliga uttalandet av det som så småningom blev känt som Gay-Lussacs lag, uppkallad efter Joseph Gay-Lussac som publicerade den 1809.
År 1803 publicerade Dalton sin lag om partialtryck, som fortfarande används av alla kemistudenter vid universitet, och som säger att i en blandning av icke-reagerande gaser är det totala gastrycket lika med summan av de enskilda gasernas partialtryck.
Daltons arbete utmärkte honom som en vetenskapsman av första rang, och han inbjöds att hålla föreläsningar vid Royal Institution i London.
Dalton och atomerna
Hans studier av gaser ledde till att Dalton började undra vad dessa osynliga ämnen egentligen var gjorda av.
Den första idén om atomer hade föreslagits mer än 2000 år tidigare av Demokritus i det antika Grekland. Demokrit trodde att allting bestod av små partiklar som kallas atomer och att dessa atomer inte kunde delas upp i mindre partiklar. Hade Demokrit rätt? Ingen visste!
Dalton skulle nu lösa detta 2000 år gamla mysterium.
Han genomförde otaliga kemiska reaktioner och publicerade 1808 det som vi nu kallar Daltons lag i sin bok A New System of Chemical Philosophy:
Om två grundämnen bildar mer än en förening mellan sig, kommer förhållandet mellan massorna av det andra grundämnet som kombineras med en fast massa av det första grundämnet att vara förhållanden av små hela tal.
Dalton fann till exempel att 12 gram kol kunde reagera med 16 gram syre för att bilda den förening som vi nu kallar kolmonoxid.
Han fann också att 12 gram kol kunde reagera med 32 gram syre för att bilda koldioxid.
Detta förhållande 32:16, som förenklat blir 2:1, fascinerade Dalton.
Analyserade han alla data han samlat in, uttalade Dalton sin övertygelse om att materia existerar i form av atomer. Han gick längre än Demokrit genom att hävda att atomer av olika grundämnen har olika massa. Han publicerade också diagram som visar till exempel:
1. Hur atomer kombineras för att bilda molekyler
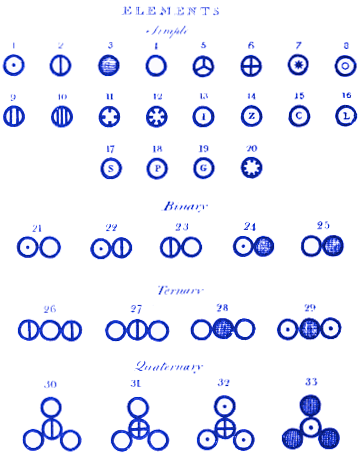

Ovanpå sitt diagram tilldelar Dalton atom 1 att vara väte, 2 kväve, 3 kol, 4 syre, 5 fosfor osv.
Han visar sedan hur molekylerna skulle kunna se ut när atomerna kombineras för att bilda föreningar. Molekyl 21 är till exempel vatten (OH), 22 är ammoniak (NH) och 23 är kväveoxid (NO). Moderna läsare kommer att se att Dalton hade fel på molekylerna 21 och 22. Detta är mindre viktigt än det faktum att Daltons system av atomer och molekyler är nästan identiskt med hur vi skulle kunna representera dem idag. Daltons molekyl 28 är till exempel koldioxid. I dag skulle vi fortfarande rita koldioxid på detta sätt.
Amedeo Avogadro publicerade snart ett arbete som byggde på Daltons och rättade till några av Daltons fel – till exempel menade Avogadro att vatten borde skrivas H20. Tyvärr ignorerades Avogadros arbete i många år, delvis på grund av att det inte stämde överens med Daltons.
2. Hur vattenmolekyler kan se ut i is
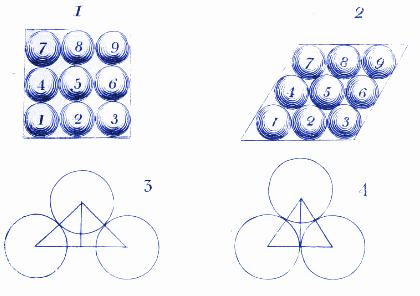

Här visar Dalton hur vattenmolekylerna kan ordna sig när de fryser i is. Vi använder liknande diagram idag för att visa hur atomer och molekyler ordnar sig i kristaller.
Daltons atomteori säger att:
1. Grundämnena består av atomer, som är små partiklar, för små för att kunna ses.
2. Alla atomer av ett visst grundämne är identiska.
3. Atomer av olika grundämnen har olika egenskaper: deras massa är olika och deras kemiska reaktioner är olika.
4. Atomer kan inte skapas, förstöras eller splittras.
5. I en kemisk reaktion kopplas atomer till varandra eller separeras från varandra.
6. Atomer kombineras i enkla heltalsförhållanden för att bilda föreningar.
Även om vi har lärt oss att atomer av samma grundämne kan ha olika massa (isotoper) och att de kan splittras i kärnreaktioner, är det mesta av Daltons atomteori fortfarande giltigt i dag, över 200 år efter att han beskrev den. Det är den grund som den moderna kemin byggdes på.
 ”Mr Daltons permanenta rykte kommer att vila på att han har upptäckt en enkel princip, som är universellt tillämpbar på kemins fakta – genom att fastställa de proportioner i vilka kroppar kombineras, och på så sätt lägga grunden för framtida arbeten … hans förtjänster i detta avseende påminner om Keplers i astronomin.”
”Mr Daltons permanenta rykte kommer att vila på att han har upptäckt en enkel princip, som är universellt tillämpbar på kemins fakta – genom att fastställa de proportioner i vilka kroppar kombineras, och på så sätt lägga grunden för framtida arbeten … hans förtjänster i detta avseende påminner om Keplers i astronomin.”
Honors
Dalton gifte sig inte och hade inga barn. Han förblev en trogen kväkare hela sitt liv och levde blygsamt.
År 1810 avböjde han en inbjudan att bli medlem i Royal Society. År 1822 blev han invald utan sin vetskap. År 1826 tilldelades han sällskapets kungliga medalj för sin atomteori.
År 1833 valde den franska vetenskapsakademin honom till en av sina åtta utländska medlemmar. År 1834 valde den amerikanska vetenskapsakademin honom till utländsk medlem.
Slutet
När han var 71 år gammal fick Dalton en liten stroke – eller förlamning som det hette på den tiden. Ett år senare gjorde en mer betydande stroke att han inte kunde tala lika tydligt som tidigare. År 1844, när han var 77 år gammal, drabbades han av ytterligare en stroke. Han dog 77 år gammal den 27 juli 1844.
Hans vetenskapliga rykte var så stort att när hans kropp placerades i Manchesters stadshus besöktes den av mer än 40 000 människor som gav sin respekt. John Dalton begravdes i Manchester på Ardwick cemetery.