ABSTRAKT: De tillgängliga antiretrovirala läkemedlen (ARV) för behandling av hiv har utökats sedan 2018. Nya typer av ARV-läkemedel med nya verkningsmekanismer har godkänts, inklusive ibalizumab-uiyk och fostemsavir. Det har också skett godkännanden av kombinationstabletter av tidigare tillgängliga läkemedel, t.ex. bictegravir/emtricitabin/tenofovir alafenamid och dolutegravir/lamivudin. Slutligen har det skett en utvidgning av godkända indikationer för tidigare tillgängliga ARV-preparat i sig själva, såsom emtricitabin/tenofovir alafenamid för användning i profylax före exponering.
US Pharm. 2020:45(10):17-25.
De viktigaste antiretrovirala medlen (ARV) för behandling av hiv har i stort sett bestått av samma handfull läkemedelsklasser i flera år. Hiv-behandling försökte man först med nukleosidhämmare för omvänt transkriptas (NRTI), den första FDA-godkända klassen av ARV-preparat. Successivt upptäcktes fler och fler klasser och gjordes tillgängliga för behandling i olika, ofta komplexa, regimer (TABELL 1).1-3 Efter godkännandet av raltegravir 2007 gällde nya godkännanden av hiv-läkemedel till stor del återanvända tillgängliga läkemedel och nya kombinationsläkemedel. Detta ändrades 2018 med godkännandet av ibalizumab-uiyk, det första nya ARV på över tio år.4 Ibalizumab-uiyk följdes snabbt av en ny icke-nukleosidhämmare av omvänt transkriptas (NNRTI), doravirin, senare samma år och en ny bindningshämmare, fostemsavir, 2020 (TABELL 2).5-7
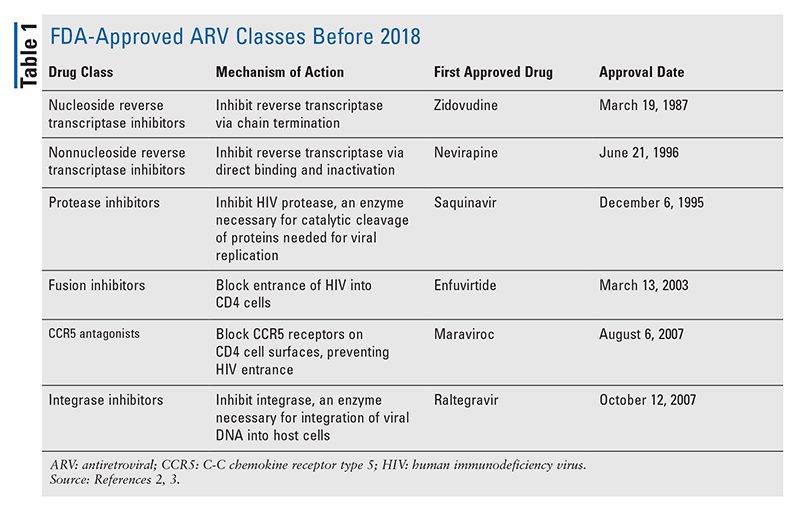
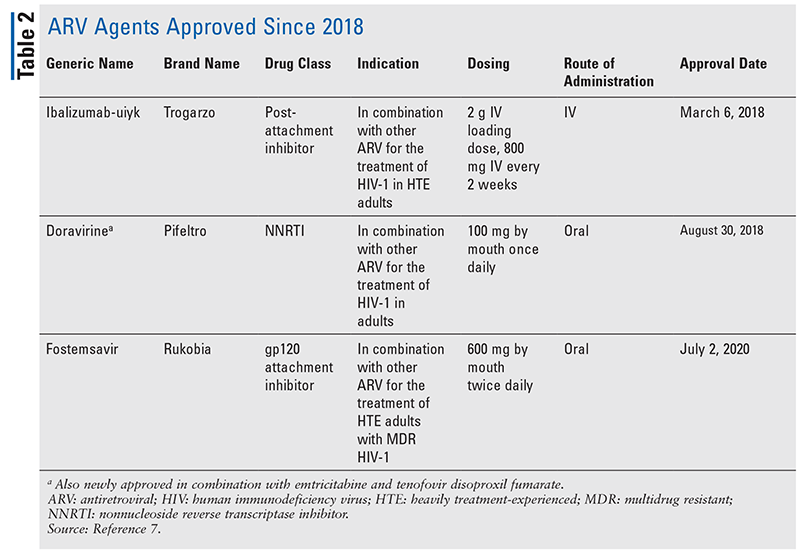
Men även om nya läkemedel ofta är de mest spännande nya läkemedelsgodkännandena, har ARV förbättrats på andra sätt. Med tanke på den enorma pillerbördan i många hiv-regimer kan nyligen godkända ARV-kombinationer (TABELL 3) göra livet mycket enklare för patienterna. Användning av sådana medel och begränsning av den nödvändiga pillerbördan har visat sig förbättra följsamheten och de övergripande resultaten.8,9 Det har också skett utvidgningar av godkända indikationer för tidigare tillgängliga ARV (TABELL 4), vilket ger nya alternativ för vissa patientpopulationer och indikationer.10-14
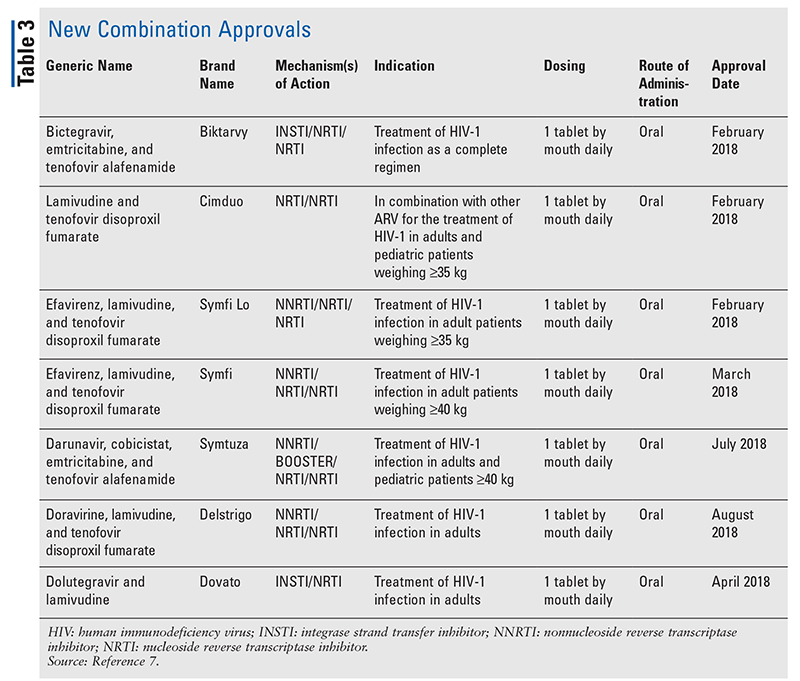
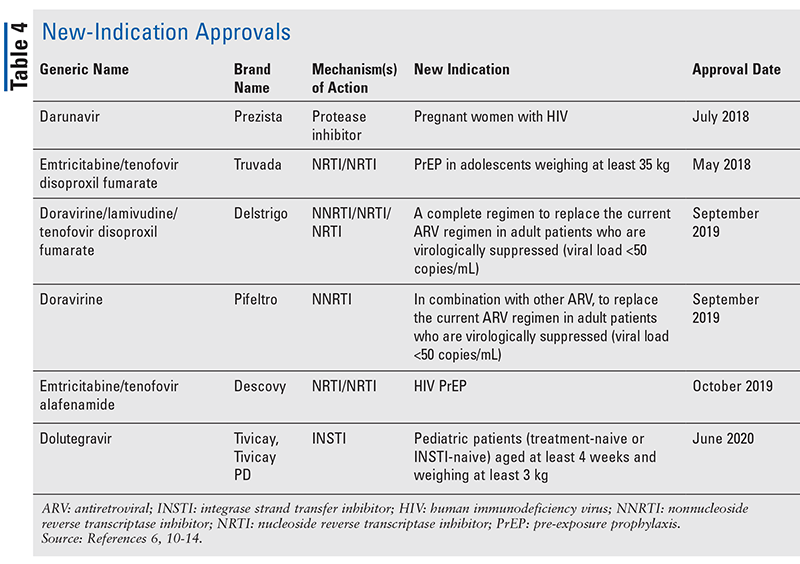
Och även om det finns många nya godkännanden sedan 2018 profilerar den här artikeln fyra av de nyligen godkända läkemedlen och en ny indikation. Dessa godkännanden valdes ut för att visa ett urval av det breda utbudet av nya medel som blir tillgängliga, samt för att betona några nya alternativ som erbjuder en unik möjlighet vid behandling av hiv.
Ibalizumab-Uiyk (Trogarzo)
Ibalizumab-uiyk är en injicerbar rekombinant monoklonal antikropp som binder till CD4-cellernas ytproteiner, vilket leder till konformationsförändringar som förhindrar stegen efter fastsättning som krävs för hiv-1 fusion och inträde i cellen. Det är det enda monoklonala läkemedlet som används för behandling av hiv. På grund av dess unika bindningsspecificitet blockerar ibalizumab-uiyk virusets inträde utan att orsaka immunosuppression, vilket är ett problem med många monoklonala läkemedel.4,15 Det är indicerat i kombination med andra ARV för behandling av kraftigt behandlingserfarna (HTE) vuxna med multiresistent (MDR) hiv-1 som inte klarar av sin nuvarande ARV-behandlingsregim.4
Godkännandet av ibalizumab-uiyk baserades på en studie som genomfördes på 40 HTE-hiv-patienter med virusbelastning större än 1 000 kopior/mL och dokumenterad resistens mot minst en NRTI, NNRTI och en proteashämmare. Patienterna måste också ha haft minst 6 månaders behandling och nyligen ha misslyckats med behandlingen. Försöket omfattade tre perioder, som inleddes med en 6-dagars period där baslinjens virusbelastning fastställdes och bekräftades (kontrollperiod). På dag 7 fick patienterna en laddningsdos på 2 000 mg ibalizumab-uiyk utöver sin standard ART-regim (funktionell monoterapiperiod). På dag 14 bedömdes virusbelastningen på nytt och regimerna övervakades och justerades för att säkerställa korrekt aktivitet mot deras hiv-infektion. Ibalizumab-uiyk 800 mg administrerades IV varannan vecka tills studien avslutades (underhållsperiod). Det primära effektmåttet utvärderade skillnaden i andelen minskad virusbelastning från kontrollperioden till den funktionella monoterapiperioden, särskilt genom att jämföra andelen patienter med en ³0,5 log10 minskning av den totala virusbelastningen. Under kontrollperioden konstaterades 3 % av patienterna ha en sådan minskning, medan den funktionella monoterapiperioden resulterade i att 83 % av patienterna uppnådde den angivna minskningen av virusbelastningen. I slutet av 25 veckor uppnådde 43 % av patienterna en virusbelastning på <50 kopior/mL.16
Baserat på denna studie är den godkända doseringen av ibalizumab-uiyk en engångsbelastningsdos på 2 000 mg i.v., följt av en underhållsdos på 800 mg i.v. varannan vecka.4,16 Noggrann övervakning krävs i 1 timme efter administrering av den första infusionen för infusionsrelaterade reaktioner, med efterföljande infusionsövervakning reducerad till 15 minuter efter tolerans av den första dosen.4 Ibalizumab-uiyk tycks i övrigt tolereras väl; de mest negativa effekterna i samband med ibalizumab-uiyk var illamående, yrsel och diarré.4,16
Fostemsavir (Rukobia)
Fostemsavir är ett nytt ARV som är indicerat för kombinationsbehandling av HTE-vuxna med känd MDR-hiv-1, särskilt för patienter som misslyckas med nuvarande ART på grund av potentiell resistens, intolerans eller säkerhetsöverväganden.4 Det är den första FDA-godkända fästningshämmaren. Efter enzymatisk aktivering till den aktiva molekylen temsavir binder den till gp120, ett glykoprotein i virushöljet som är nödvändigt för att viruset ska kunna fästa vid CD4-celler. Detta förhindrar att viruset kommer in i CD4-cellerna, vilket effektivt stoppar virusreplikationen. På grund av denna nya mekanism är det osannolikt att fostemsavir framkallar resistens mot sig självt genom det selektiva tryck som är förknippat med de flesta andra ARV.6,17
Fostemsavir utvärderades med avseende på både säkerhet och effekt i en randomiserad, dubbelblindad, placebokontrollerad klinisk prövning (BRIGHTE) som omfattade 371 hiv-1-patienter med HTE.16,17 Patienterna i huvudkohorten behandlades med både sin baslinje ART-regim tillsammans med antingen fostemsavir 600 mg två gånger dagligen eller placebo i totalt 8 dagar. Vid bedömning dag 8 uppvisade fostemsavirpatienterna signifikant lägre serumnivåer av viralt hiv-RNA. Efter denna inledande behandlingsperiod övergick alla patienter till fostemsavir 600 mg två gånger dagligen. Vid 24 veckor uppnådde 53 % av studiedeltagarna effektiva odetekterbara nivåer av virussuppression, och suppressionen förbättrades till 60 % vid vecka 96.17,18
Den vanligaste rapporterade biverkningen av fostemsavir var illamående. Allvarligare reaktioner, inklusive förhöjda leverenzymer, rapporterades hos patienter med hepatit B- eller C-koinfektion.17,18 Andra studier rapporterade mindre förekomst av huvudvärk, utslag och diarré. Den aktiva metaboliten temsavir metaboliseras av CYP3A4, så starka inducerare som karbamazepin, rifampicin och johannesört bör undvikas för att förhindra minskad serumkoncentration av temsavir17-19.
Bictegravir/Emtricitabin/TenofovirAlafenamid (Biktarvy)
Bictegravir/Emtricitabin/TenofovirAlafenamid (BIC/FTC/TAF) är en kombinationstablett med fast dos, som tas en gång dagligen, och som innehåller en ny integrashämmare och två nukleosid/nykelotid-omvända transkriptashämmare. De enskilda komponenterna i Biktarvy är biktegravir 50 mg (en integrase strängöverföringshämmare ), emtricitabin 200 mg (en NRTI) och tenofovir alafenamid 25 mg (en NRTI). BIC/FTC/TAF är indicerat som en komplett regim hos hiv-1-infekterade vuxna utan anamnes på ART eller för att ersätta den nuvarande ART-regimen hos patienter som är virologiskt undertryckta (virusbelastning £ 50 kopior per mL) på en stabil ARV-regim i minst 3 månader och som inte har någon anamnes på behandlingsmisslyckande eller resistens mot dess enskilda komponenter. Mest betydelsefullt är att det är en komplett regim med en tablett som inte kräver några andra ARV.20
BIC/FTC/TAF godkändes 2018 efter fyra kliniska prövningar. Två av de kliniska prövningarna testade BIC/FTC/TAF:s effektivitet och säkerhet hos patienter som inte har någon historia av ART: Trial 1489 (randomiserad, BIC/FTC/TAF jämfört med abacavir/ dolutegravir/lamivudin, och Trial 1490 (randomiserad, BIC/FTC/TAF jämfört med dolutegravir + emtricitabin/tenofovir alafenamid ).21,22 I prövning 1489 uppnåddes den primära slutpunkten av virusbelastning <50 kopior/mL i 92 % av BIC/FTC/TAF-gruppen och 93 % av ABC/DTG/3TC-gruppen (behandlingsskillnad -0,6 %; 95 % konfidensintervall , -4,8 % till 3,6 %). I prövning 1490 uppnåddes den primära slutpunkten av virusbelastning <50 kopior/mL hos 89 % av BIC/FTC/TAF-gruppen och 93 % av DTG + FTC/TAF-gruppen (behandlingsskillnad på -3,5 %; 95 % KI, -7,9 % till 1,0 %).21,22
De andra två prövningarna testade effekten och säkerheten hos BIC/FTC/TAF hos virologiskt supprimerade patienter som skulle övergå från sina nuvarande ART-regimer till BIC/FTC/TAF: Trial 1844 (randomiserad, byte från dolutegravir plus abakavir/lamivudin eller ABC/DTG/3TC till BIC/FTC/TAF) och Trial 1878 (öppen, byte från atazanavir eller boosted darunavir plus abakavir/emtricitabin eller emtricitabin/tenofovirdisoproxilfumarat till BIC/FTC/TAF).23,24 I prövning 1844 sågs den primära slutpunkten av patienter som förlorade sin status för virologisk suppression (virusbelastning ³50 kopior per mL) hos 1 % av BIC/FTC/TAF-gruppen och <1 % av gruppen med den ursprungliga regimen (behandlingsskillnad på 0,7 %, 95 % KI, -1,0 % till 2,8 %). I studie 1878 sågs den primära slutpunkten av patienter som förlorade sin status för virologisk suppression hos 2 % av BIC/FTC/TAF-gruppen och 2 % av gruppen med den ursprungliga regimen (behandlingsskillnad på 0,0 %; 95 % KI, -2,5 % till 2,5 %).23,24
BIC/FTC/TAF doseras en gång dagligen genom munnen med eller utan mat. De vanligast rapporterade biverkningarna som sågs hos patienterna var diarré, illamående och huvudvärk.20-24
Dolutegravir/Lamivudin (Dovato)
Kombinationen dolutegravir/lamivudin (DTG/3TC), en INSTI och NRTI, godkändes 2019. Det är den första kompletta regimen med två läkemedel i fasta doser för behandling av hiv-1-infektion hos behandlingsnaiva vuxna patienter. Detta står i kontrast till de traditionellt krävda standardbehandlingsalternativen med tre läkemedel. Detta kan erbjuda möjligheter för patienter som inte kan tolerera någon av de vanligare tre läkemedelsregimerna på grund av biverkningar eller oundvikliga läkemedelsinteraktioner.25,26
Den effektiva och säkra effekten av kombinationen dolutegravir/lamivudin visades i två identiska studier, GEMINI-1 och GEMINI-2.27 I dessa studier rekryterades totalt 1 433 hiv-1-infekterade, behandlingsnaiva vuxna som randomiserades till att få en tvåläkemedelsregim, dolutegravir 50 mg plus lamivudin 150 mg, eller en treläkemedelsregim, dolutegravir plus emtricitabin plus tenofovir disoproxilfumarat. Det primära effektmåttet att uppnå en virusbelastning <50 kopior/mL visade att DTG/3TC inte var bättre – 91 % av de 716 patienterna med två läkemedel och 93 % av de 717 patienterna med tre läkemedel (behandlingsskillnad på -1,7 %; 95 % KI, -4,4 % till 1,1 %) – när resultaten från de två studierna slogs samman. De sammanslagna studierna visade också att det numeriskt sett var färre patienter som drabbades av läkemedelsrelaterade biverkningar i tvåläkemedelsregimen jämfört med treläkemedelsregimen (126 av 716 respektive 169 av 717 ). På grund av den icke-sämre effekten och en liknande tolerabilitetsprofil kunde Department of Health and Human Services inkludera fast doserad kombination DTG/3TC i riktlinjerna för hiv/aids som en rekommenderad initial regim för de flesta personer med hiv.27
Kombinationen dolutegravir/lamivudin doseras en gång dagligen genom munnen med eller utan mat. De vanligaste biverkningarna som ses hos patienter är huvudvärk, illamående, diarré, trötthet och sömnlöshet. Trots att det är en kombinationstablett med två läkemedel behöver den inte administreras tillsammans med andra ARV-läkemedel eftersom det är en komplett behandlingsregim.25-27
Emtricitabin/Tenofovir alafenamid för profylax före exponering (PrEP)
Sedan 2012 har det enda FDA-godkända alternativet för PrEP varit FTC/TDF.11 Detta ändrades 2019 med godkännandet av kombinationsläkemedlet emtricitabin/Tenofovir alafenamid (FTC/TAF),13 som är ett strukturellt liknande kombinationsläkemedel. Det är nu indicerat för användning i PrEP hos oinfekterade patienter med hög risk för hivöverföring via sexuellt umgänge. Detta utesluter patienter som löper risk genom receptivt vaginalt samlag, eftersom denna population ännu inte har utvärderats.
Godkännandet av PrEP baseras på den nyligen genomförda DISCOVER-studien, en randomiserad, dubbelblind studie som jämförde FTC/TAF med standardbehandling med FTC/TDF när det gäller att minska risken för att förvärva hiv-1-infektion hos män och transsexuella kvinnor som har sex med män och som löper risk att drabbas av hiv-1-infektion.7 Studien genomfördes som en randomiserad, dubbelblind, parallellgruppsstudie med en uppföljning på minst 48 veckor, där minst 50 % av deltagarna hade 96 veckors uppföljning efter randomisering. Den rekryterade 5 399 deltagare som randomiserades 1:1 till någon av grupperna. Studiens primära mål var att bedöma förekomsten av hiv-1-infektion per 100 personår. Bland de 2 694 deltagarna i FTC/TAF-armen sågs hiv-1-incidens hos 7 patienter (0,16/100 personår). Bland de 2 693 deltagarna i FTC/TDF-armen sågs hiv-1-incidens hos 15 patienter (0,34/100 personår). Dessa incidenser visar att FTC/TAF inte var sämre än FTC/TDF hos studiedeltagare som riskerade att få hiv och gjorde det i slutändan möjligt för FDA att lägga till PrEP till indikationerna för FTC/TAF.13
FTC/TAF:s plats i hivbehandlingen är sannolikt fortfarande oklar. Även om det har funnit användning inom andra områden av hiv-behandlingen, är dess fördel jämfört med alternativet i denna miljö ännu inte slutgiltigt fastställd. Även om den är likartad kan TAF erbjuda en lägre förekomst av förändringar i bentätheten och njurdysfunktion, biverkningar som förknippas med TDF. Denna skillnad är dock inte väl etablerad, och vissa uppgifter tyder på att denna fördel kanske inte är kliniskt betydelsefull i regimer som inte innehåller en farmakokinetisk booster, t.ex. kobicistat eller ritonavir. 27-29
Slutsats
På grund av hiv:s komplexitet och dess potential för resistens kan ARV-behandling snabbt bli betungande för patienterna. Mellan 2018 och idag har det medicinska samfundet sett en stor expansion av FDA-godkända ARV-terapier för behandling av hiv. Dessa terapier omfattar nya kombinationstabletter med fasta doser, nya läkemedel som fungerar genom andra mekanismer än de som tidigare funnits på marknaden och till och med nya indikationer för tidigare existerande mediciner. Dessa nya läkemedel har redan påverkat de nuvarande behandlingsriktlinjerna och kan hjälpa patienterna att leva längre och friskare liv.
Innehållet i den här artikeln är endast avsett för informationsändamål. Innehållet är inte avsett att ersätta professionell rådgivning. Att förlita sig på information som tillhandahålls i denna artikel sker uteslutande på egen risk.
1. Vella S, Schwartländer B, Sow SP, et al. Historien om antiretroviral behandling och dess genomförande i resursbegränsade områden i världen. AIDS. 2012;26(10):1231-1241.
2. Arts EJ, Hazuda DJ. Antiretroviral läkemedelsbehandling av hiv-1. Cold Spring Harb Perspect Med. 2012;2(4):a007161.
3. Chaudhuri S, Symons JA, Deval J. Innovation and trends in the development and approval of antiviral medicines: 1987-2017 och därefter. Antiviral Res. 2018;155:76-88.
4. Trogarzo (ibalizumab-uiyk) bipacksedel. Montreal, Quebec: Theratechnologies Inc; mars 2018.
5. Pifeltro (doravirin) bipacksedel. Whitehouse Station, NJ: Merck & Co, Inc; mars 2019.
6. Rukobia (fostemsavir) bipacksedel. Research Triangle Park, NC: GlaxoSmithKline; juli 2020.
7. Pan F, Chernew ME, Fendrick AM. Effekten av kombinationsläkemedel med fasta doser på följsamhet till receptbelagda läkemedel. J Gen Intern Med. 2008;23(5):611-614.
8. Verma AA, Khuu W, Tadrous M,et al. Fixed-dose combination antihypertensive medications, adherence, and clinical outcomes: a population-based retrospective cohort study. PLoS Med. 2018;15(6):e1002584.
9. National Institutes of Health. HIVinfo. FDA-godkända hiv-mediciner. hivinfo.nih.gov/understanding-hiv/fact-sheets/fda-approved-hiv-medicines. Tillgänglig den 22 september 2020.
10. Prezista (darunavir) bipacksedel. Titusville, NJ: Janssen Therapeutics; maj 2019.
11. Truvada (emtricitabin/tenofovirdisoproxilfumarat) bipacksedel. Foster City, CA: Gilead Sciences, Inc; juni 2004/2020.
12. Delstrigo (doravirin/lamivudin/tenofovir disproxilfumarat) bipacksedel. White House Starion, NJ: Merck & Co, Inc; augusti 2018.
13. Descovy (emtricitabin/tenofovir alafenamid) bipacksedel. Foster City, CA: Gilead Sciences, Inc; december 2019.
14. Tivicay (dolutegravir) bipacksedel. Research Triangle Park, NC. GlaxoSmithKline; juni 2020.
15. Iacob SA, Iacob DG. Ibalizumab med inriktning på CD4-receptorer, en ny molekyl i hiv-behandling. Front Microbiol. 2017;8:2323.
16. Emu B, Fessel J, Schrader S, et al. Fas 3-studie av ibalizumab för multiresistent hiv-1. N Engl J Med. 2018;379:645-654.
17. Li Z, Zhou N, Sun Y, et al. Aktivitet hos hiv-1-anslutningshämmaren BMS-626529, den aktiva komponenten i prodrogen BMS-663068, mot CD4-oberoende virus och hiv-1-höljen som är resistenta mot andra inträdeshämmare. Antimicrob Agents Chemother. 2013:57(9):4172-4180.
18. Kozal M, Aberg J, Pialoux G. Fostemsavir hos vuxna med multiresistent hiv-1-infektion. N Engl J Med. 2020;382(13):1232-1243.
19. Cahn P, Fink V, Patterson P. Fostemsavir: en ny CD4-anslutningshämmare. Curr Opin HIV AIDS. 2018;13(4):341-345.
20. Biktarvy (biktecgravir/emtricitabin/tenofovir alafenamid) bipacksedel. Foster City, CA: Gilead Sceinces, Inc; februari 2018.
21. Gallant J, Lazzarin A, Mills M, et al. Bictegravir, emtricitabin och tenofovir alafenamid jämfört med dolutegravir, abacavir och lamivudin för initial behandling av hiv-1-infektion (GS-US-380-1489): en dubbelblind, multicenter, fas 3, randomiserad kontrollerad non-inferiority trial. Lancet. 2017;390(10107):2063-2072.
22. Sax PE, Pozniak A, Montes M, et al. Coformulated bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir with emtricitabine and tenofovir alafenamide, for initial treatment of HIV-1 infection (GS-US-380-1490): a randomised, double-blind, multicentre, phase 3, non-inferiority trial. Lancet. 2017;390(10107):2073-2082.
23. Malina JM, Ward D, Brar I, et al. Byte till fast dos bictegravir, emtricitabin och tenofovir alafenamid från dolutegravir plus abacavir ochlamivudin hos virologiskt supprimerade vuxna med hiv-1: 48 veckors resultat av en randomiserad, dubbelblind, multicenter, aktivt kontrollerad, fas 3, non-inferiority trial. Lancet HIV. 2018;5(7):E357-E365.
24. Daar ES, De Jesus E, Ruane P, et al. Efficacy and safety of switching to fixed-dose bictegravir, emtricitabine, and tenofovir alafenamide from boosted protease inhibitor-based regimens in virologically suppressed adults with HIV-1: 48-week results of a randomised, open-label, multicentre, phase 3, non-inferiority trial. Lancet HIV. 2018;5(7):e347-e356.
25. Dovato (dolutegravir/lamivudin) bipacksedel. Research Triangle Park, NC: GlaxoSmithKline. Mars 2020.
26. Scott LJ. Dolutegravir/lamivudin regim med en enda tablett: en genomgång vid hiv-1-infektion. Drugs. 2020;80(1):61-72.
27. Cahn P, Madero JS, Arribas JR, et al. GEMINI Study Team. Dolutegravir plus lamivudin jämfört med dolutegravir plus tenofovir disoproxilfumarat och emtricitabin hos antiretroviralt naiva vuxna med hiv-1-infektion (GEMINI-1 och GEMINI-2): resultat vecka 48 från två multicenter, dubbelblinda, randomiserade, non-inferiority, fas 3-studier. Lancet. 2019;393(10167):143-155.
28. Mayer KH, Molina JM, Thompson MA, et al. Emtricitabin och tenofovir alafenamid vs. emtricitabin och tenofovir disoproxilfumarat för profylax före exponering av hiv (DISCOVER): primära resultat från en randomiserad, dubbelblind multicenter, aktivt kontrollerad, fas 3-studie med icke-inferioritet. Lancet. 2020;396(10246):239-254.
29. Hill A, Hughes SL, Gotham D, Pozniak AL. Tenofovir alafenamid jämfört med tenofovir disoproxilfumarat: finns det en verklig skillnad i effekt och säkerhet? J Virus Erad. 2018;4(2):72-79.