Chemisté oceňují izotopy a využívají je v základním i aplikovaném výzkumu. Více se však zabývají pohybem elektronů. Když atom získává nebo ztrácí elektrony, stává se nabitým druhem neboli iontem. Když k tomu dojde, jádro se nezmění. U atomů, které ztratí elektrony, vznikne celkový kladný náboj (#protony > #elektrony). Atomy, které tvoří tyto typy iontů, se nazývají kationty. Atomy kovů (nacházející se na levé straně periodické tabulky) vždy ztrácejí elektrony a stávají se kationty.
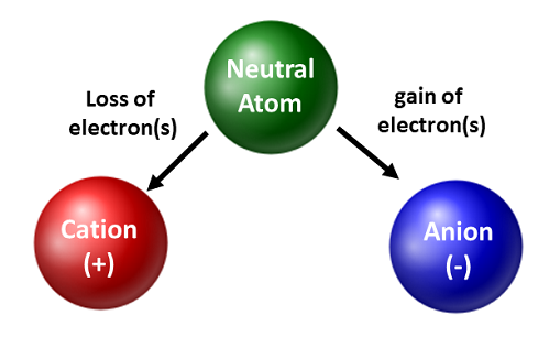
Na rozdíl od atomů kovů získávají nekovy elektrony a stávají se anionty. Tyto typy iontů mají celkový záporný náboj (#elektrony > #protony). S výjimkou vzácných plynů budou všechny atomy periodické tabulky ztrácet nebo získávat elektrony, aby dosáhly elektronické stability. Různé typy vazeb vznikají, když atomy ztrácejí, získávají nebo sdílejí elektrony. Tyto typy atomových vazeb budou blíže probrány ve 4. kapitole učebnice.
Interaktivní: Stavba atomu
Sestavte atom z protonů, neutronů a elektronů a sledujte, jak se mění prvek, náboj a hmotnost. Pak si zahrajte hru, ve které si ověříte své představy!
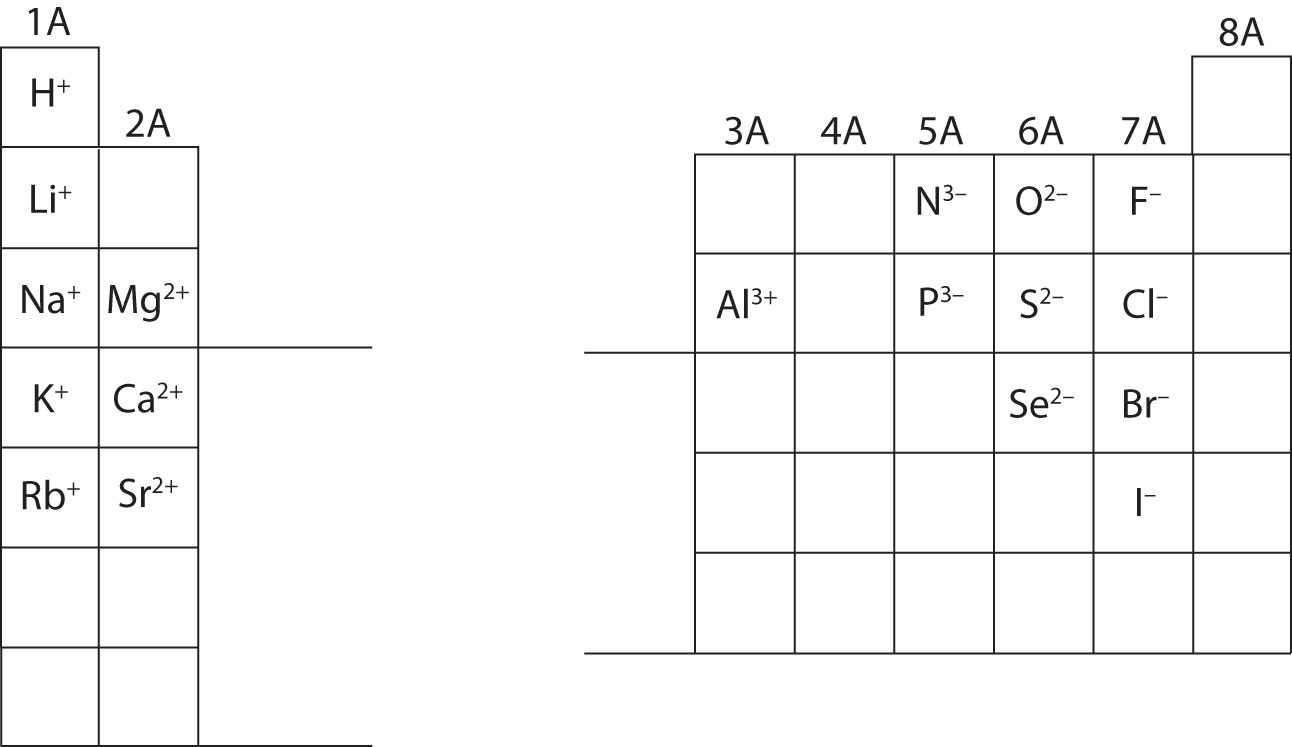
V tuto chvíli byste měli být schopni vypočítat všechny subatomární částice při zadání konkrétního náboje iontu. Kromě toho byste měli zvládnout klasifikaci iontů (rozpoznat, že kationty jsou kladné a anionty záporné). Zapamatování nábojů konkrétních iontů bude nutné při práci na kapitole 4 v učebnici. Prozatím budou náboje iontů poskytnuty a neměly by být zapamatovány. Všimněte si a zhodnoťte iontové náboje prvků hlavních skupin v periodické tabulce níže. A konečně, chemici nepíší číslo pro náboje zahrnující číslo jedna (1). U těchto druhů uvidíte pouze znaménko + nebo -. Náboje větší velikosti budou mít vždy číslo spojené se symbolem prvku.
Příklad \(\PageIndex{1}\):
Vypočítejte subatomární částice pro níže uvedené druhy pomocí informací na obrázku \(\PageIndex{2}\). Označte každou z nich jako atom, kationt nebo aniont. Hmotnosti, atomová čísla a specifické náboje iontů najdete v periodické tabulce.
- Hliníkový ion
- Atom zirkonia
- Sírový ion
Roztoky
- Hliníkový ion má 13 protonů, 14 neutronů a 10 elektronů. Tento ion je kladně nabitý, což znamená, že ztratil elektrony a tvoří kationt.
- V atomu zirkonia je 40 protonů, 51 neutronů a 40 elektronů. Jedná se o atom, který nemá celkový náboj.
- V iontu síry je 16 protonů, 16 neutronů a 18 elektronů. Tento ion je záporně nabitý, což znamená, že získal elektrony a tvoří aniont.
Příklad \(\PageIndex{2}\): Napište A/Z a symbolové zápisy hmotností
Napište A/Z a symbolové zápisy hmotností pro ionty/atomy v předchozí otázce.
Řešení
- \(\ce{^{27}_{13}Al^{3+}}\) a Al-27
- \(\ce{^{91}_{40}Zr}\) a Zr-.91
- \(\ce{^{32}_{16}S}^{2-}\) a S-32
Pokud atom získává nebo ztrácí elektrony, mělo by to být znázorněno ve formátu A/Z. Ve formátu symbol-hmotnost se nezobrazuje náboj iontu. Nezapomeňte, že neutrony a protony nejsou změnami elektronů ovlivněny.
Potřebujete další procvičování?
- Přejděte k části 3.E tohoto OER a vypracujte úlohy č. 5 a 9.
Přispěvatelé
-
Elizabeth R. Gordon (Furman University)
.