Os químicos apreciam isótopos e os utilizam na pesquisa básica e aplicada. No entanto, eles estão mais preocupados com o movimento dos elétrons. Quando um átomo ganha ou perde elétrons, ele se torna uma espécie carregada ou um íon. Quando isso ocorre, o núcleo não é alterado. Para átomos que perdem elétrons, uma carga geral positiva resultará (#protões > # elétrons). Os átomos que formam esses tipos de íons são chamados de cátions. Átomos metálicos (localizados no lado esquerdo da tabela periódica) sempre perdem elétrons para se tornarem cátions.
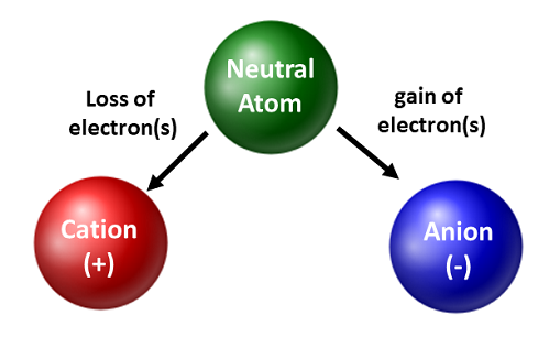
Átomos metálicos não semelhantes, os não metálicos ganharão elétrons para se tornarem ânions. Estes tipos de iões têm uma carga global negativa (#electrões > #protões). Com exceção dos gases nobres, todos os átomos da tabela periódica perderão ou ganharão elétrons para alcançar a estabilidade eletrônica. Diferentes tipos de ligação ocorrem quando os átomos perdem, ganham ou compartilham elétrons. Estes tipos de ligações atómicas serão discutidos mais detalhadamente no capítulo 4 do seu manual.
Interactiva: Construindo um Átomo
Build um átomo a partir de prótons, nêutrons e elétrons, e veja como o elemento, carga e massa mudam. Depois jogue um jogo para testar suas idéias!
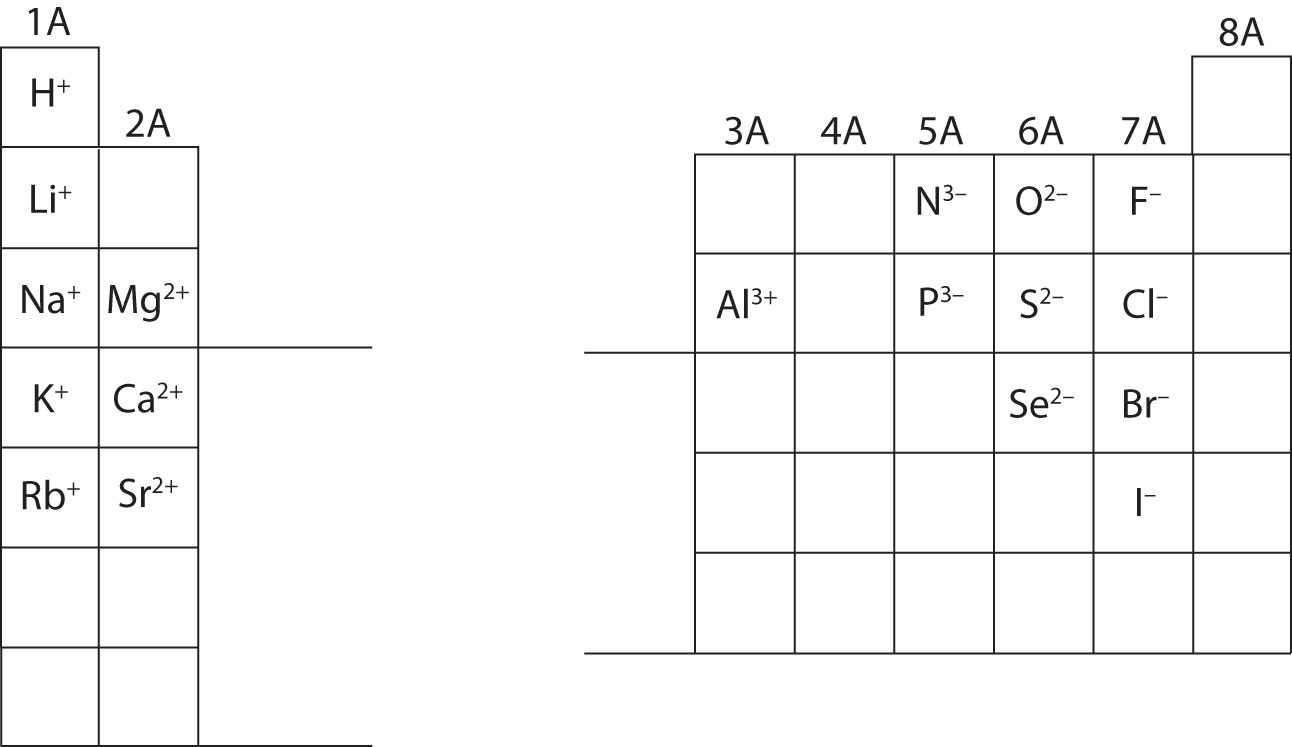
Neste ponto, você deve ser capaz de calcular todas as partículas subatômicas quando dada uma carga específica de íons. Além disso, você deve dominar as classificações de íons (reconhecendo que os cátions são positivos e os ânions são negativos). A memorização das cargas de íons específicos será necessária quando se trabalhar no capítulo 4 do livro didático. Por enquanto, as cargas de íons serão fornecidas e não devem ser memorizadas. Observe e aprecie as cargas de íons para os principais elementos do grupo na tabela periódica abaixo. Finalmente, os químicos não escrevem um número para as cargas que envolvem o número um (1). Para estas espécies, você verá apenas um sinal + ou -. As cargas de maior magnitude terão sempre um número associado ao símbolo elementar.
Exemplo \(\PageIndex{1}}): Classificação Iônica
Calcular as partículas subatômicas para as espécies abaixo usando as informações da Figura \PageIndex{2}}. Rotule cada uma delas como sendo um átomo, catião ou ânion. Consulte a tabela periódica para massas, números atômicos e cargas específicas de íons.
- Íon de alumínio
- Atom de zircônio
- Íon de enxofre
Soluções
- Existem 13 prótons, 14 nêutrons e 10 elétrons no íon de alumínio. Este íon é carregado positivamente, o que significa que perdeu elétrons e forma um catião.
- Existem 40 prótons, 51 nêutrons e 40 elétrons no átomo de zircônio. Este é um átomo que não tem carga total.
- There are 16 protons, 16 neutrons, and 18 electrons in the sulfur ion. Este íon tem carga negativa, o que significa que ganhou elétrons e formas e ânion.
Exemplo {2}(\PageIndex{2}): A/Z e notações de massa dos símbolos
Escreva A/Z e notações de massa dos símbolos para o ião/atom na pergunta anterior.
Soluções
- ({^{27}_{13}_Al^{3+}} e Al-27
- ({^{91}_{40}Zr}}) e Zr-91
- \({^{32}_{16}S}^{2-}) e S-32
Se um átomo ganhar ou perder electrões, isto deve ser representado no formato A/Z. O formato símbolo de massa não exibe carga de íons. Lembre-se, os neutrões e prótons não são afetados por mudanças de elétrons.
Need More Practice?
- Virar para a Seção 3.E deste OER e problemas de trabalho #5 e #9.
Contribuidores
-
Elizabeth R. Gordon (Furman University)