化学者は同位体を高く評価し、基礎および応用研究に利用しています。 しかし、彼らは電子の動きのほうに関心がある。 原子が電子を得たり失ったりすると、荷電種やイオンになる。 このとき、原子核は変化しない。 電子を失った原子では、全体的に正の電荷が生じます(#プロトン > #電子)。 このようなイオンを形成する原子は陽イオンと呼ばれます。 周期表の左側にある金属原子は、必ず電子を失って陽イオンになる
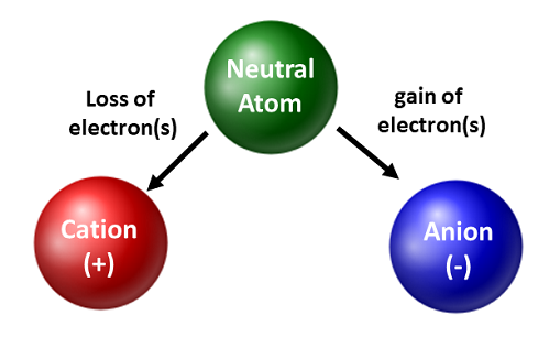
金属原子と異なり、非金属は電子を獲得して陰イオンになる。 この種のイオンは、全体として負の電荷(#電子 > #プロトン)を持っています。 希ガスを除き、周期表上のすべての原子は電子を失ったり、得たりして電子的安定性を獲得します。 原子が電子を失ったり、得たり、共有したりすることで、さまざまな種類の結合が発生する。 これらのタイプの原子結合については、教科書の第 4 章でさらに詳しく説明します。
インタラクティブ。 原子を作る
陽子、中性子、電子から原子を作り、元素、電荷、質量がどのように変化するかを見ることができます。 その後、自分の考えを試すためにゲームをします!
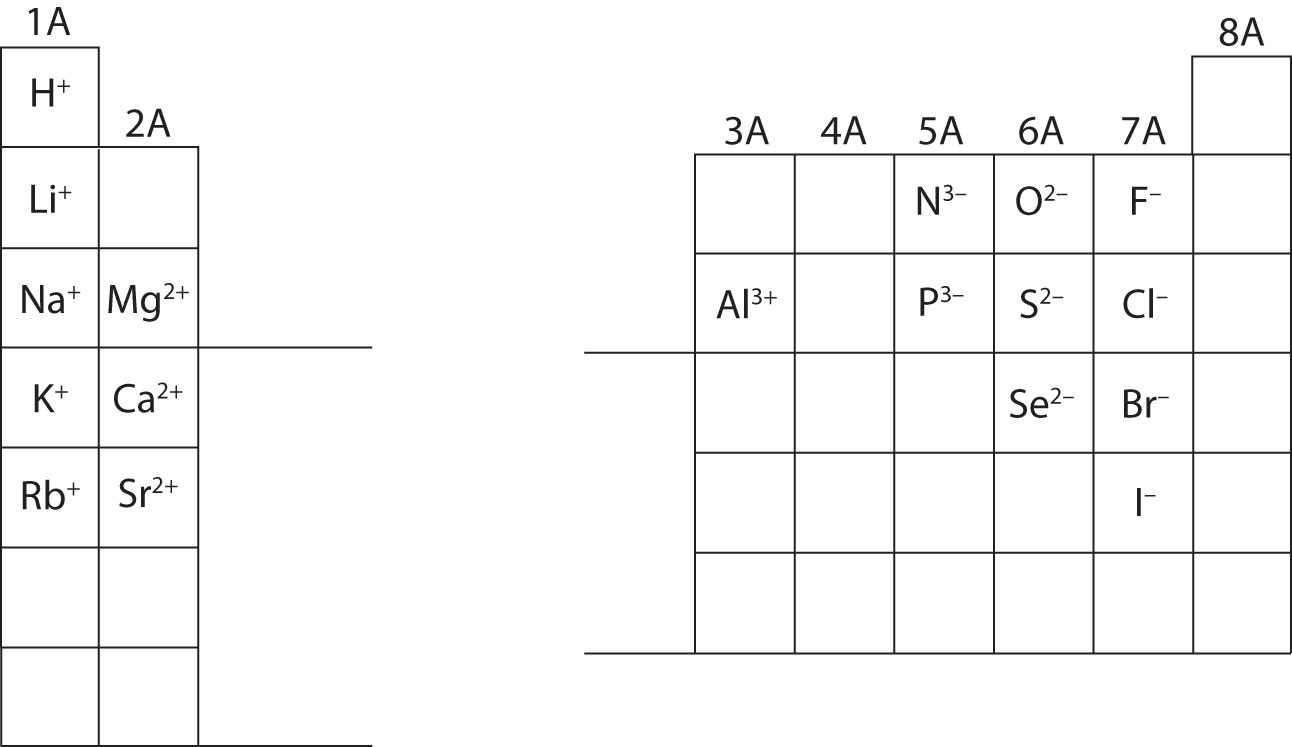
この時点で、特定のイオン電荷を与えられたときに、すべての素粒子を計算できるようになっているはずです。 さらに、イオンの分類(陽イオンはプラス、陰イオンはマイナスという認識)をマスターしておく必要があります。 特定のイオンの電荷を暗記することは、教科書の第4章に取り組む際に必要となる。 今は、イオンの電荷を覚える必要はない。 以下の周期表の主族元素のイオン電荷をメモして鑑賞してください。 最後に、化学者は数字の1(1)を含む電荷には数字を書きません。 これらの種では、+または-記号のみが表示されます。
Example ⒶⒶ。 IOnic Classification
図の情報を使って、下の種の素粒子を計算しなさい♪ \(PageIndex{2}): No. それぞれに原子、陽イオン、陰イオンのラベルを貼る。 質量、原子番号、イオンの電荷は周期表を参照すること。 このイオンは正に帯電しており、電子を失って陽イオンを形成していることを意味します。 これは全体として電荷を持たない原子です。
Example \(\PageIndex{2}).This ion is negatively charged which has gained electrons and forms anion: A/Zと記号の質量表記
前問のイオン/原子について、A/Zと記号の質量表記を書きなさい。
解答
- ◇(\ce{^{27}_{13}Al^{3+}}) and Al-27
- ◇(\ce{^{91}_{40}Zr}) and Zr-
- ◇ (\ce{^{67}) and Al-27
- \(\ce{^{32}_{16}S}^{2-}}) and S-32
) ◇ (|1405> ◇ (|1405) ◇ (|1405})91
原子が電子を獲得したり失ったりする場合。 をA/Z形式で表示します。 記号-質量形式では、イオンの電荷は表示されません。 中性子や陽子は電子の変化には影響されないことを忘れないでください。7753>
Contributors
-
Elizabeth R. Gordon (Furman University)