I chimici apprezzano gli isotopi e li usano nella ricerca di base e applicata. Tuttavia, sono più interessati al movimento degli elettroni. Quando un atomo guadagna o perde elettroni, diventa una specie carica o uno ione. Quando questo accade, il nucleo non viene alterato. Per gli atomi che perdono elettroni, risulterà una carica positiva complessiva (#protoni > #elettroni). Gli atomi che formano questi tipi di ioni sono chiamati cationi. Gli atomi di metallo (situati sul lato sinistro della tavola periodica) perdono sempre elettroni per diventare cationi.
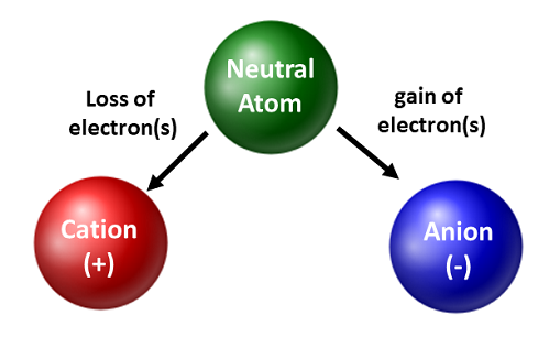
A differenza degli atomi di metallo, i non metalli guadagneranno elettroni per diventare anioni. Questi tipi di ioni hanno una carica negativa complessiva (#elettroni > #protoni). Con l’eccezione dei gas nobili, tutti gli atomi della tavola periodica perdono o guadagnano elettroni per raggiungere la stabilità elettronica. Diversi tipi di legame si verificano quando gli atomi perdono, guadagnano o condividono elettroni. Questi tipi di legami atomici saranno ulteriormente discussi nel capitolo 4 del tuo libro di testo.
Interattivo: Costruire un atomo
Costruisci un atomo con protoni, neutroni ed elettroni e vedi come cambiano l’elemento, la carica e la massa. Poi fai un gioco per testare le tue idee!
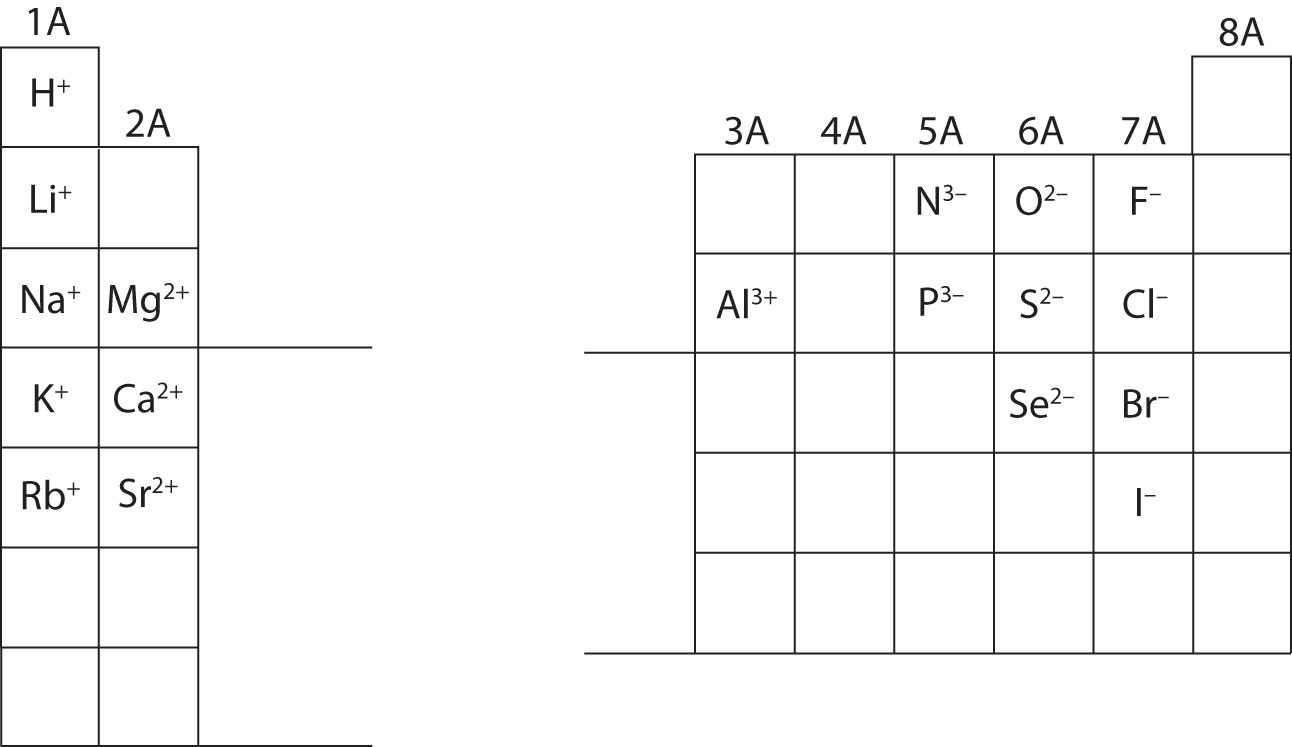
A questo punto, dovresti essere in grado di calcolare tutte le particelle subatomiche quando ti viene data una specifica carica ionica. Inoltre, dovresti padroneggiare le classificazioni degli ioni (riconoscendo che i cationi sono positivi e gli anioni sono negativi). Memorizzare le cariche di ioni specifici sarà richiesto quando si lavorerà sul capitolo 4 del libro di testo. Per ora, le cariche degli ioni saranno fornite e non dovrebbero essere memorizzate. Nota e apprezza le cariche ioniche per gli elementi del gruppo principale nella tabella periodica qui sotto. Infine, i chimici non scrivono un numero per le cariche che coinvolgono il numero uno (1). Per queste specie, vedrai solo un segno + o -. Le cariche di grandezza superiore avranno sempre un numero associato al simbolo dell’elemento.
Esempio \(\PageIndex{1}): Classificazione IOnica
Calcolate le particelle subatomiche per le specie qui sotto usando le informazioni della figura \(\PageIndex{2}}). Etichetta ciascuna come atomo, catione o anione. Fai riferimento alla tavola periodica per le masse, i numeri atomici e le cariche specifiche degli ioni.
- Ione alluminio
- Atomo di zirconio
- Ione zolfo
Soluzioni
- Lo ione alluminio contiene 13 protoni, 14 neutroni e 10 elettroni. Questo ione è caricato positivamente, il che significa che ha perso elettroni e forma un catione.
- Ci sono 40 protoni, 51 neutroni e 40 elettroni nell’atomo di zirconio. Questo è un atomo che non ha carica complessiva.
- Ci sono 16 protoni, 16 neutroni e 18 elettroni nello ione zolfo. Questo ione è caricato negativamente, il che significa che ha guadagnato elettroni e forma un anione.
Esempio \(\PageIndex{2}\): Notazioni di massa A/Z e simboli
Scrivi le notazioni di massa A/Z e simboli per gli ioni/atomi della domanda precedente.
Soluzioni
- \(\ce{27}_{13}Al^{3+}}) e Al-27
- \(\ce{91}_{40}Zr}} e Zr-91
- \(\ce{^{32}_{16}S}^{2-}) e S-32
Se un atomo guadagna o perde elettroni, questo dovrebbe essere rappresentato nel formato A/Z. Il formato simbolo-massa non visualizza la carica dello ione. Ricorda, neutroni e protoni non sono influenzati dai cambiamenti di elettroni.
Hai bisogno di più pratica?
- Torna alla Sezione 3.E di questa OER e risolvi i problemi #5 e #9.
Contribuenti
-
Elizabeth R. Gordon (Furman University)