Kemikere værdsætter isotoper og bruger dem i grundforskning og anvendt forskning. De er dog mere optaget af elektronernes bevægelse. Når et atom får eller taber elektroner, bliver det en ladet art eller en ion. Når dette sker, ændres kernen ikke. For atomer, der mister elektroner, vil der opstå en samlet positiv ladning (#protoner > #elektroner). Atomer, der danner disse typer ioner, kaldes kationer. Metalatomer (placeret på den venstre side af det periodiske system) mister altid elektroner og bliver til kationer.
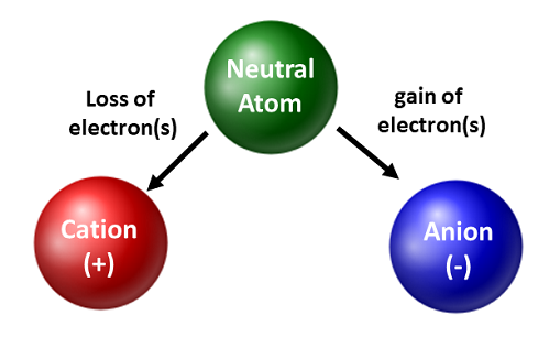
I modsætning til metalatomer vil ikke-metaller få elektroner for at blive til anioner. Disse typer ioner har en samlet negativ ladning (#elektroner > #protoner). Med undtagelse af ædelgasserne vil alle atomer i det periodiske system miste eller få elektroner for at opnå elektronisk stabilitet. Der opstår forskellige typer af bindinger, når atomer mister, får eller deler elektroner. Disse typer af atomforbindelser vil blive diskuteret yderligere i kapitel 4 i din lærebog.
Interaktiv: Opbygning af et atom
Byg et atom op af protoner, neutroner og elektroner, og se, hvordan grundstoffet, ladningen og massen ændres. Spil derefter et spil for at afprøve dine idéer!
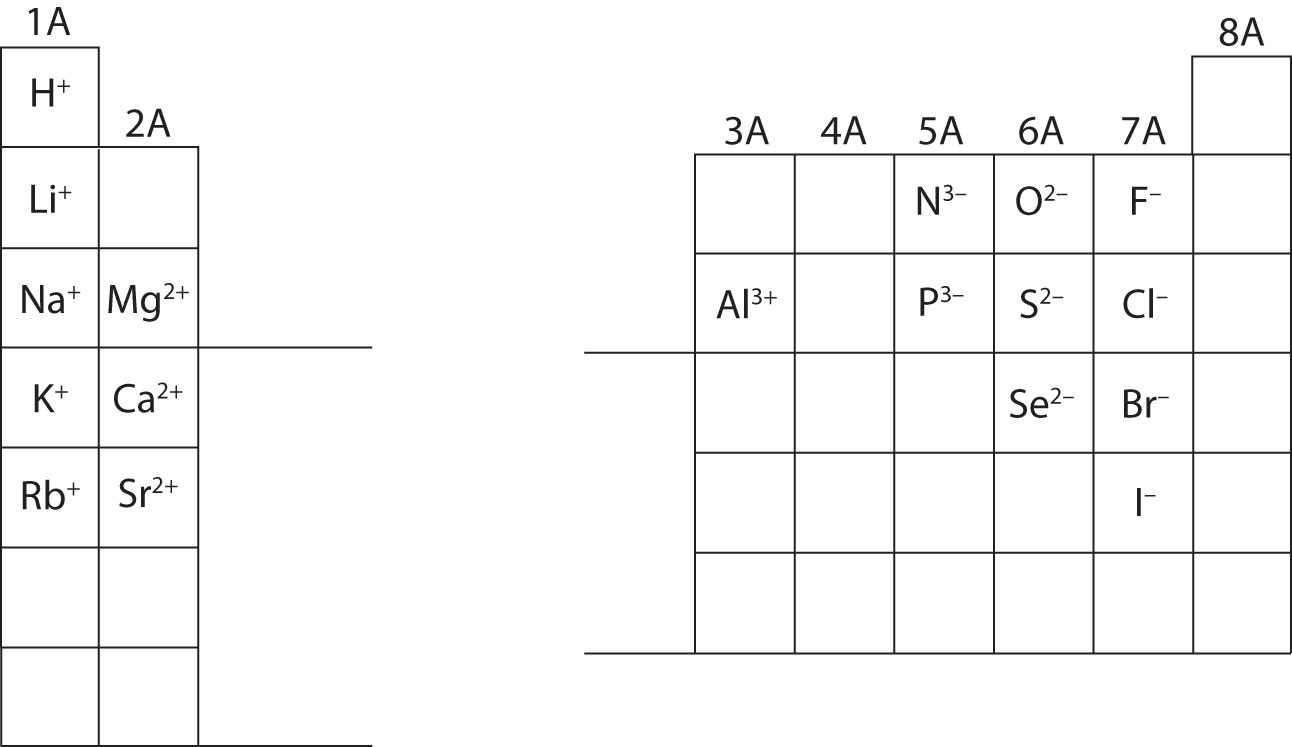
På dette tidspunkt bør du være i stand til at beregne alle subatomare partikler, når de får en bestemt ionladning. Desuden bør du beherske klassifikationer af ioner (du bør erkende, at kationer er positive og anioner er negative). Det vil være nødvendigt at huske ladninger af specifikke ioner, når du arbejder med kapitel 4 i lærebogen. Indtil videre vil ionladninger blive givet og skal ikke læres udenad. Bemærk og værdsæt ionladningerne for grundstofferne i hovedgruppen i det periodiske system nedenfor. Endelig skriver kemikere ikke et tal for ladninger, der omfatter tallet et (1). For disse arter vil du kun se et + eller – tegn. Ladninger af højere størrelsesorden vil altid have et tal forbundet med grundstofsymbolet.
Eksempel \(\PageIndex{1}\): IOnisk klassifikation
Beregne de subatomare partikler for nedenstående arter ved hjælp af oplysningerne i figur \(\PageIndex{2}\). Mærk hver af dem som værende et atom, en kation eller en anion. Se det periodiske system for masse, atomnumre og specifikke ionladninger.
- Aluminiumsion
- Zirconiumatom
- Svovlion
Løsninger
- Der er 13 protoner, 14 neutroner og 10 elektroner i aluminiumionen. Denne ion er positivt ladet, hvilket betyder, at den har mistet elektroner og danner en kation.
- Der er 40 protoner, 51 neutroner og 40 elektroner i zirconiumatomet. Det er et atom, som ikke har nogen samlet ladning.
- Der er 16 protoner, 16 neutroner og 18 elektroner i svovlionen. Denne ion er negativt ladet, hvilket betyder, at den har fået elektroner og danner en anion.
Eksempel \(\PageIndex{2}\): A/Z- og symbolmassebetegnelser
Skriv A/Z- og symbolmassebetegnelser for ionerne/atomerne i det foregående spørgsmål.
Løsninger
- \(\ce{^{27}_{13}Al^{3+}}}\) og Al-27
- \(\ce{^{91}_{40}Zr}}\) og Zr-91
- \(\ce{^ce{^{{32}_{16}S}^{2-}}\) og S-32
Hvis et atom får eller taber elektroner, skal dette repræsenteres i A/Z-formatet. Symbol-masse-formatet viser ikke ionladning. Husk, at neutroner og protoner ikke påvirkes af ændringer af elektroner.
Har du brug for mere øvelse?
- Vend tilbage til afsnit 3.E i denne OER og løser opgaverne #5 og #9.
Medarbejdere
-
Elizabeth R. Gordon (Furman University)