Chemici waarderen isotopen en gebruiken ze in fundamenteel en toegepast onderzoek. Zij zijn echter meer bezorgd over de beweging van elektronen. Wanneer een atoom elektronen krijgt of verliest, wordt het een geladen soort of een ion. Wanneer dit gebeurt, wordt de kern niet veranderd. Voor atomen die elektronen verliezen, zal een algemene positieve lading resulteren (#protonen > #elektronen). Atomen die dit soort ionen vormen worden kationen genoemd. Metaalatomen (aan de linkerkant van het periodiek systeem) verliezen altijd elektronen om kationen te worden.
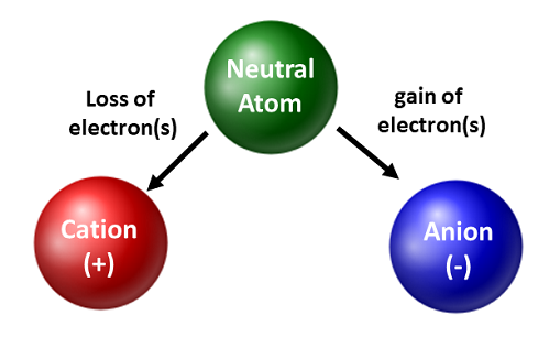
In tegenstelling tot metaalatomen krijgen niet-metalen elektronen om anionen te worden. Deze soorten ionen hebben een algemene negatieve lading (#elektronen > #protonen). Met uitzondering van de edelgassen, zullen alle atomen op het periodiek systeem elektronen verliezen of winnen om elektronische stabiliteit te bereiken. Verschillende soorten bindingen komen voor wanneer atomen elektronen verliezen, winnen, of delen. Deze soorten atomaire verbindingen worden verder besproken in hoofdstuk 4 van je tekstboek.
Interactief: Bouw een atoom
Bouw een atoom uit protonen, neutronen en elektronen, en zie hoe het element, de lading en de massa veranderen. Speel vervolgens een spel om je ideeën te testen!
Op dit punt moet je in staat zijn om alle subatomaire deeltjes te berekenen wanneer je een specifieke ionlading krijgt. Bovendien moet je de classificatie van ionen beheersen (herkennen dat kationen positief zijn en anionen negatief). Het onthouden van ladingen van specifieke ionen zal nodig zijn bij het werken aan hoofdstuk 4 in het tekstboek. Voorlopig worden de ladingen van ionen gegeven en moeten ze niet uit het hoofd geleerd worden. Noteer en waardeer de ionenladingen voor de elementen van de hoofdgroep in het periodiek systeem hieronder. Tenslotte schrijven scheikundigen geen getal voor ladingen waarbij het getal één (1) betrokken is. Voor deze soorten ziet u alleen een + of – teken. Ladingen van grotere omvang hebben altijd een nummer dat bij het elementaire symbool hoort.
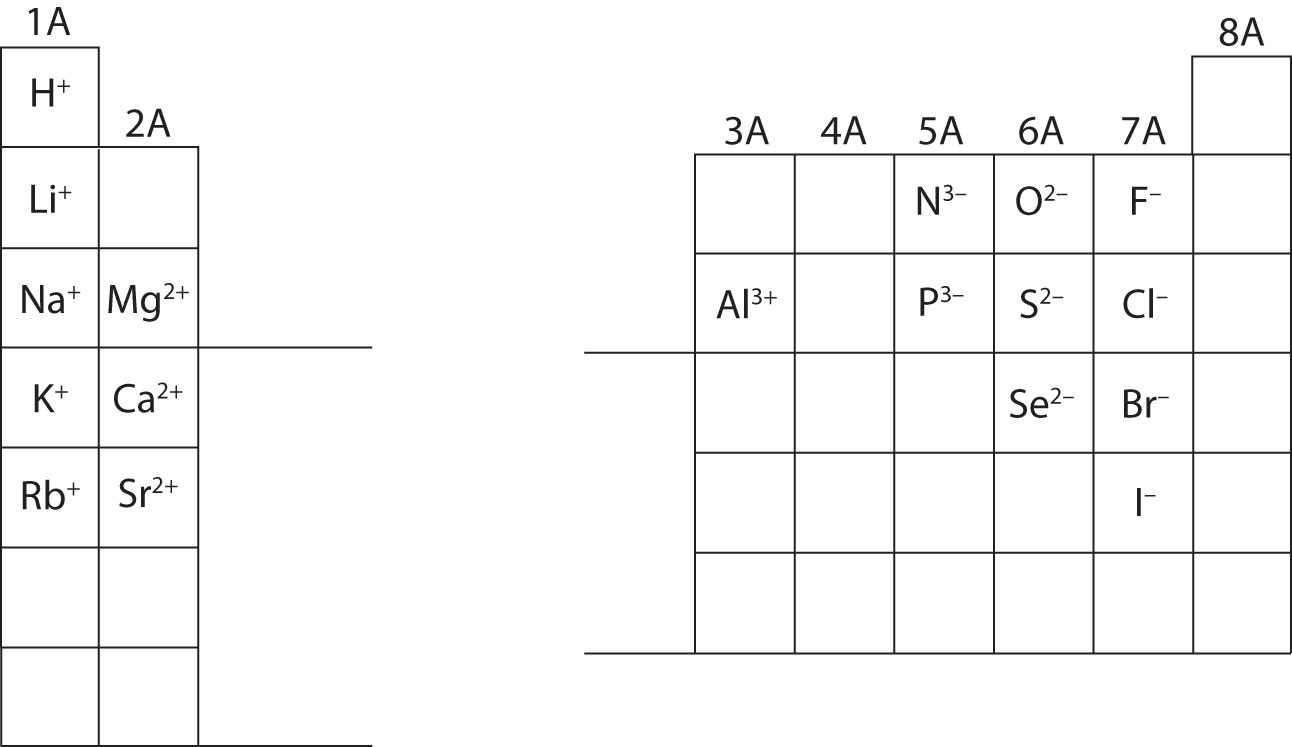
Voorbeeld (\PageIndex{1}): IOnic Classification
Bereken de subatomaire deeltjes voor de onderstaande soorten met behulp van de informatie in figuur
. Benoem elk als atoom, kation of anion. Raadpleeg het periodiek systeem voor massa’s, atoomnummers en specifieke ionladingen.
- Aluminium ion
- Zirkonium atoom
- Zwavel ion
Oplossingen
- Er zijn 13 protonen, 14 neutronen, en 10 elektronen in het aluminium ion. Dit ion is positief geladen, wat betekent dat het elektronen heeft verloren en een kation vormt.
- Er zijn 40 protonen, 51 neutronen, en 40 elektronen in het zirkoniumatoom. Dit is een atoom dat geen algemene lading heeft.
- Er zijn 16 protonen, 16 neutronen, en 18 elektronen in het zwavelion. Dit ion is negatief geladen, wat betekent dat het elektronen heeft gewonnen en een anion vormt.
Voorbeeld: A/Z- en symboolmassa notaties
Schrijf A/Z- en symboolmassa notaties voor de ionen/atomen uit de vorige vraag.
Oplossingen
- (\ce{^{27}_{13}Al^{3+}}) en Al-27
- (\ce{^{91}_{40}Zr}) en Zr-91
- (^^{32}_{16}S}^{2-}) en S-32
Als een atoom elektronen wint of verliest, moet dit worden weergegeven op het A/Z-formaat. Het symbool-massaformaat geeft de lading van het ion niet weer. Onthoud dat neutronen en protonen niet worden beïnvloed door veranderingen van elektronen.
Meer oefening nodig?
- Neem deel 3.E van deze OER en werk de problemen #5 en #9 uit.
Bijdragers
-
Elizabeth R. Gordon (Furman University)