. Pro kyseliny a zásady existuje stupnice, stejně jako pro všechno ostatní. Zde je několik definic, které byste měli znát:
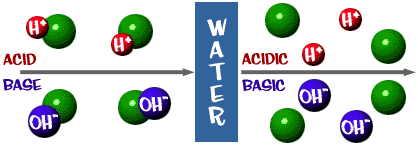
Kyselina: Roztok, který má přebytek iontů H+. Pochází z latinského slova acidus, což znamená „ostrý“ nebo „kyselý“.
Základ: Roztok, který má přebytek iontů OH-. Jiný výraz pro zásadu je alkalický.
Vodný: Roztok, který je tvořen převážně vodou. Zamyslete se nad slovem akvárium. AQUA znamená voda.
Silná kyselina:
Silná zásada: Kyselina, která má velmi nízké pH (0-4): Zásada, která má velmi vysoké pH (10-14).
Slabá kyselina: Kyselina, která se ve vodném roztoku ionizuje jen částečně. To znamená, že ne každá molekula se rozpadá. Slabé kyseliny mají obvykle pH blízké 7 (3-6).
Slabá zásada: Zásada, která ve vodném roztoku ionizuje pouze částečně. To znamená, že ne každá molekula se rozpadá. Slabé zásady mají obvykle pH blízké 7 (8-10).
Neutrální: Roztok, který má pH 7. Není ani kyselý, ani zásaditý.
Říkali jsme ti o tom Arrheniovi a jeho představách o koncentracích vodíkových a hydroxidových iontů. Také se dozvíte o Brønstedových-Lowryho myšlenkách. Tito dva chemici z Dánska a Anglie se dívali na kyseliny jako na donory a na zásady jako na akceptory. Co byly jejich donory a akceptory? Vodíkové ionty. Je to hodně podobné první definici, kterou jsme uvedli, kdy se kyselina rozpadá a uvolňuje/donuje vodíkový ion. Tato novější definice je trochu podrobnější. Vědci novou definici použili k popisu více zásad, například amoniaku (NH3). Protože báze jsou akceptory protonů, když bylo pozorováno, že amoniak přijímá H+ a vytváří amonný ion (NH4+), mohl být označen jako báze. S hydroxidovými ionty jste si již nemuseli dělat starosti. Pokud získal H+ z molekuly vody, pak byla voda (H2O) donorem protonu. Znamená to, že voda byla v této situaci kyselinou? Ano.
Lékař jménem Lewis nabídl třetí způsob, jak se dívat na kyseliny a zásady. Místo na vodíkové ionty se díval na dvojice elektronů (vzpomínáte si na naše obrázky s bodovými strukturami v knize Atomy a prvky?). Podle Lewisova názoru kyseliny přijímají páry elektronů a zásady páry elektronů odevzdávají. Víme, že oba tyto popisy kyselin a zásad používají zcela opačné termíny, ale myšlenka je stejná. Vodíkové ionty stále chtějí přijmout dva elektrony, aby vytvořily vazbu. Zásady je chtějí odevzdat. Celkově Lewisova definice dokázala zařadit ještě více sloučenin mezi kyseliny nebo zásady.
Co se skutečně děje?
Co se skutečně děje v těchto roztocích? Tady to začíná být trochu složitější. Podívejme se pro jistotu ještě jednou na rozpad molekul ve vodných (vodných) roztocích. Kyseliny jsou sloučeniny, které po umístění do vodného roztoku disociují (rozpadají se) na vodíkové (H+) ionty a další sloučeninu. Vzpomínáte si na příklad s kyselinou octovou? Zásady jsou sloučeniny, které se po umístění do vodného roztoku rozpadají na hydroxidové ionty (OH-) a jinou sloučeninu. O jedlé sodě si povíme za několik odstavců.
Změníme trochu formulaci. Pokud máte iontovou/elektrovou sloučeninu a vložíte ji do vody, rozpadne se na dva ionty. Pokud je jedním z těchto iontů H+, je roztok kyselý. Příkladem je silná kyselina chlorovodík (HCl). Pokud je jeden z iontů OH-, je roztok zásaditý. Příkladem silné zásady je hydroxid sodný (NaOH). Existují i další ionty, které tvoří kyselé a zásadité roztoky, ale o nich zde nebudeme hovořit.
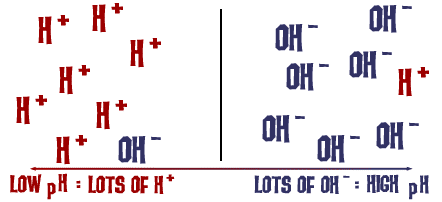
Ta stupnice pH, o které jsme mluvili, je vlastně měřítkem počtu iontů H+ v roztoku. Pokud je v roztoku hodně iontů H+, je pH velmi nízké. Pokud je v roztoku hodně iontů OH- v porovnání s počtem iontů H+, je pH vysoké.
Přemýšlejte chvíli o této myšlence: Proč by kapalina s vysokým obsahem NaOH měla být velmi zásaditá, ale zároveň nebezpečná? Vazba Na-OH se v roztoku přeruší a vzniknou sodíkové ionty (kladné) a hydroxidové ionty (záporné). Ionty sodíku v roztoku nepředstavují skutečné nebezpečí, ale v roztoku je obrovské množství hydroxidových iontů ve srovnání s vodíkovými ionty, které se mohou vznášet jako H3O+ (hydroniový ion). všechny tyto přebytečné ionty OH- způsobují, že pH je velmi vysoké a roztok snadno reaguje s mnoha sloučeninami. Totéž se děje v méně nebezpečném měřítku, když do vody přidáte jedlou sodu. Při disociaci se v roztoku uvolňují ionty OH- a kyselina uhličitá. Počet iontů OH- je větší než počet iontů H3O+ (H+ a H2O) a pH se zvyšuje. Jen to není tak silný rozdíl jako u hydroxidu sodného.
To je v podstatě vše. (Ha ha! Chápete?)
Další informace najdete v první části.
Související video…
Encyclopædia Britannica: Báze
Wikipedia: Kyseliny
Wikipedia: Báze
Encyclopedia.com: Acids
Encyclopedia.com: Báze