Lássuk most a teljes képet. A savaknak és bázisoknak is van skálája, mint minden másnak. Íme néhány meghatározás, amit érdemes ismerned:
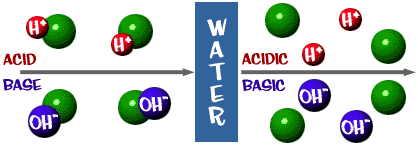
Sav: Olyan oldat, amelyben többlet H+ ion van. A latin acidus szóból származik, amelynek jelentése “éles” vagy “savanyú”.
Bázis: Olyan oldat, amelyben OH- ionok vannak feleslegben. A bázis másik szava az alkáli.
Vizes: Olyan oldat, amely főként vízből áll. Gondolj az akvárium szóra. Az AQUA azt jelenti, hogy víz.
Erős sav: Olyan sav, amelynek nagyon alacsony a pH-ja (0-4).
Erős bázis: Olyan bázis, amelynek nagyon magas a pH-ja (10-14).
Gyenge sav: Olyan sav, amely vizes oldatban csak részben ionizálódik. Ez azt jelenti, hogy nem minden molekula bomlik szét. A gyenge savak pH-ja általában 7-hez közeli (3-6).
Gyenge bázis: Olyan bázis, amely csak részben ionizálódik vizes oldatban. Ez azt jelenti, hogy nem minden molekula esik szét. A gyenge bázisok pH-ja általában 7 (8-10) közelében van.
Semleges: Olyan oldat, amelynek pH-ja 7. Nem savas és nem bázikus.
Beszéltünk neked arról az Arrhenius fickóról és a hidrogén- és hidroxidionok koncentrációjára vonatkozó elképzeléseiről. Tanulni fogsz a Brønsted-Lowry-féle elképzelésekről is. Ez a két dán és angol kémikus a savakat donorként, a bázisokat pedig akceptorként tekintette. Mit adományoztak és mit fogadtak el? Hidrogénionokat. Ez nagyon hasonlít az első definícióhoz, amit adtunk, amikor egy sav felbomlik és hidrogéniont szabadít fel/adományoz. Ez az újabb definíció egy kicsit részletesebb. A tudósok az új definíciót több bázis, például az ammónia (NH3) leírására használták. Mivel a bázisok protonelfogadók, amikor az ammóniát egy H+ -ot befogadó és egy ammóniumiont (NH4+) létrehozó ammóniát láttak, bázisként lehetett megjelölni. Többé nem kellett aggódni a hidroxidionok miatt. Ha a H+-t egy vízmolekulától kapta, akkor a víz (H2O) volt a protondonor. Ez azt jelenti, hogy ebben a helyzetben a víz volt a sav? Igen.
Egy Lewis nevű kémikus egy harmadik módszert ajánlott a savak és bázisok vizsgálatára. Ahelyett, hogy a hidrogénionokat nézte volna, az elektronpárokat vizsgálta (emlékszel az Atomok és elemek című fejezetben a pontszerkezetes képeinkre?). Lewis szerint a savak elektronpárokat vesznek fel, a bázisok pedig elektronpárokat adnak le. Tudjuk, hogy a savak és bázisok e két leírása teljesen ellentétes kifejezéseket használ, de az ötlet ugyanaz. A hidrogénionok továbbra is két elektront akarnak felvenni, hogy kötést alakítsanak ki. A bázisok le akarják adni őket. Összességében Lewis definíciója még több vegyületet tudott savak vagy bázisok közé sorolni.
Mi történik valójában?
Mi történik valójában ezekben az oldatokban? Itt egy kicsit bonyolulttá válik a dolog. A biztonság kedvéért nézzük meg még egyszer a molekulák bomlását vizes (vizes) oldatokban. A savak olyan vegyületek, amelyek vizes oldatba kerülve hidrogén (H+) ionokra és egy másik vegyületre disszociálnak (bomlanak). Emlékszel az ecetsav példára? A bázisok olyan vegyületek, amelyek vizes oldatba helyezve hidroxid (OH-) ionokra és egy másik vegyületre bomlanak. Néhány bekezdés múlva a szódabikarbónáról fogunk beszélni.
Változtassuk meg egy kicsit a megfogalmazást. Ha van egy ionos/elektrovalens vegyületünk, és vízbe tesszük, akkor két ionra bomlik szét. Ha az egyik ion H+, akkor az oldat savas. Az erős sav hidrogén-klorid (HCl) egy példa erre. Ha az egyik ion OH-, akkor az oldat bázikus. Erős bázisra példa a nátrium-hidroxid (NaOH). Vannak más ionok is, amelyek savas és bázikus oldatokat alkotnak, de ezekről itt nem fogunk beszélni.
A pH-skála, amiről beszéltünk, valójában az oldatban lévő H+ ionok számát méri. Ha sok H+ ion van, akkor a pH nagyon alacsony. Ha a H+ ionok számához képest sok OH- ion van, akkor a pH magas.
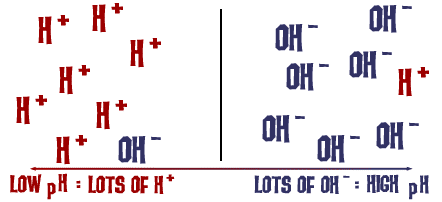
Gondolkodj el ezen a gondolaton egy pillanatra: Miért lenne egy folyadék, amelyben sok NaOH van, nagyon bázikus, ugyanakkor veszélyes? A Na-OH kötés oldatban felszakad, és nátriumionok (pozitív) és hidroxidionok (negatív) keletkeznek. A nátriumionok nem igazán jelentenek veszélyt az oldatban, de az oldatban rengeteg hidroxidion van a hidrogénionokhoz képest, amelyek H3O+ (hidróniumion) formájában lebeghetnek az oldatban. a sok felesleges OH-ion miatt a pH nagyon magas lesz, és az oldat sok vegyülettel könnyen reakcióba lép. Ugyanez történik kevésbé veszélyes mértékben, amikor szódabikarbónát adunk a vízhez. A disszociáció során OH- ionok és szénsav szabadul fel az oldatban. Az OH- ionok száma nagyobb, mint a H3O+ ionoké (H+ és H2O), és a pH megnő. Csak nem olyan erős a különbség, mint a nátrium-hidroxid esetében.
Lényegében ennyi. (Ha ha! Érted?)
Még több információ az első részben.
Kapcsolódó videó…
Encyclopædia Britannica: Bázisok
Wikipedia: Wikipédia: Savak
Wikipedia: Bázisok
Encyclopedia.com: Bázisok: Savak
Encyclopedia.com: Bases