Spójrzmy teraz na cały obraz. Istnieje skala dla kwasów i zasad, tak jak wszystko inne. Oto kilka definicji, które powinieneś znać:
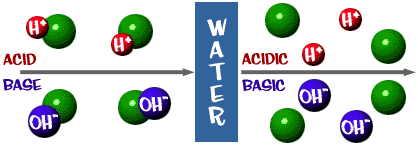
Kwas: Roztwór, który ma nadmiar jonów H+. Pochodzi od łacińskiego słowa acidus, co oznacza „ostry” lub „kwaśny”.
Zasada: Roztwór, który ma nadmiar jonów OH-. Innym określeniem zasady jest alkalia.
Wodny: Roztwór, który składa się głównie z wody. Pomyśl o słowie akwarium. AQUA oznacza wodę.
Silny kwas: Kwas, który ma bardzo niskie pH (0-4).
Strong Base: Zasada, która ma bardzo wysokie pH (10-14).
Słaby kwas: Kwas, który tylko częściowo jonizuje się w roztworze wodnym. Oznacza to, że nie każda cząsteczka ulega rozpadowi. Słabe kwasy mają zwykle pH zbliżone do 7 (3-6).
Słaba zasada: Baza, która tylko częściowo jonizuje się w roztworze wodnym. Oznacza to, że nie każda cząsteczka rozpada się. Słabe zasady mają zwykle pH bliskie 7 (8-10).
Neutralny: Roztwór, który ma pH równe 7. Nie jest ani kwaśny, ani zasadowy.
Powiedzieliśmy wam o tym facecie Arrheniusie i jego pomysłach na temat stężenia jonów wodorowych i wodorotlenkowych. Dowiecie się również o ideach Brønsteda-Lowry’ego. Ci dwaj chemicy z Danii i Anglii patrzyli na kwasy jako donory i zasady jako akceptory. Co oni oddawali i przyjmowali? Jony wodoru. To jest bardzo podobne do pierwszej definicji, którą podaliśmy, gdzie kwas rozpada się i uwalnia/dodaje jon wodorowy. Ta nowsza definicja jest nieco bardziej szczegółowa. Naukowcy użyli tej nowej definicji do opisania większej ilości zasad, takich jak amoniak (NH3). Ponieważ zasady są akceptorami protonów, kiedy widziano amoniak przyjmujący H+ i tworzący jon amonowy (NH4+), można go było oznaczyć jako zasadę. Nie trzeba było się już martwić o jony wodorotlenkowe. Jeśli otrzymał H+ z cząsteczki wody, to woda (H2O) była dawcą protonu. Czy to oznacza, że woda była w tej sytuacji kwasem? Tak.
Chemik o nazwisku Lewis zaproponował trzeci sposób patrzenia na kwasy i zasady. Zamiast patrzeć na jony wodoru, patrzył na pary elektronów (pamiętasz nasze obrazki ze strukturami kropkowymi w Atomach i Pierwiastkach?). W ujęciu Lewisa kwasy przyjmują pary elektronów, a zasady oddają pary elektronów. Wiemy, że oba te opisy kwasów i zasad używają zupełnie przeciwstawnych terminów, ale idea jest ta sama. Jony wodorowe nadal chcą przyjąć dwa elektrony, aby utworzyć wiązanie. Zasady chcą je oddać. Ogólnie rzecz biorąc, definicja Lewisa była w stanie sklasyfikować jeszcze więcej związków jako kwasy lub zasady.
Co naprawdę się dzieje?
Co tak naprawdę dzieje się w tych roztworach? Tutaj sprawa robi się nieco skomplikowana. Dla porządku przyjrzyjmy się jeszcze raz rozpadowi cząsteczek w roztworach wodnych. Kwasy są związkami, które dysocjują (rozpadają się) na jony wodoru (H+) i inny związek, gdy są umieszczone w roztworze wodnym. Pamiętasz przykład z kwasem octowym? Zasady to związki, które po umieszczeniu w roztworze wodnym rozpadają się na jony wodorotlenku (OH-) i inny związek. Porozmawiamy o sodzie oczyszczonej w kilku akapitach.
Zmieńmy trochę sformułowanie. Jeśli masz związek jonowy/elektrowalencyjny i umieścisz go w wodzie, rozpadnie się on na dwa jony. Jeśli jednym z tych jonów jest H+, to roztwór jest kwaśny. Silny kwas chlorowodór (HCl) jest jednym z przykładów. Jeśli jednym z jonów jest OH-, roztwór jest zasadowy. Przykładem silnej zasady jest wodorotlenek sodu (NaOH). Istnieją inne jony, które tworzą roztwory kwaśne i zasadowe, ale nie będziemy o nich tutaj mówić.
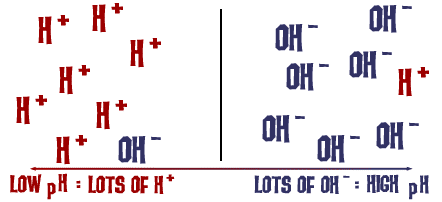
Ta skala pH, o której mówiliśmy, jest w rzeczywistości miarą liczby jonów H+ w roztworze. Jeśli jest dużo jonów H+, pH jest bardzo niskie. Jeśli jest dużo jonów OH- w porównaniu z liczbą jonów H+, pH jest wysokie.
Pomyśl o tym pomyśle przez chwilę: Dlaczego ciecz z dużą ilością NaOH miałaby być bardzo zasadowa, a jednocześnie niebezpieczna? Wiązanie Na-OH pęka w roztworze i mamy jony sodu (dodatnie) i jony wodorotlenku (ujemne). Jony sodu nie stanowią zagrożenia w roztworze, ale w roztworze znajduje się ogromna liczba jonów wodorotlenkowych w porównaniu z jonami wodorowymi, które mogą unosić się w powietrzu jako H3O+ (jon hydroniowy). Nadmiar jonów OH- powoduje, że pH jest bardzo wysokie, a roztwór łatwo wchodzi w reakcje z wieloma związkami. To samo dzieje się na mniej niebezpieczną skalę, kiedy dodajemy sodę oczyszczoną do wody. Podczas dysocjacji w roztworze uwalniane są jony OH- i kwas węglowy. Liczba jonów OH- jest większa niż liczba jonów H3O+ (H+ i H2O), a pH wzrasta. Nie jest to tylko tak silna różnica jak w przypadku wodorotlenku sodu.
To w zasadzie wszystko. (Ha ha! Łapiesz?)
Więcej informacji w części pierwszej.
Powiązane wideo…
Encyclopædia Britannica: Bases
Wikipedia: Acids
Wikipedia: Bases
Encyclopedia.com: Acids
Encyclopedia.com: Bases