Lad os nu se på hele billedet. Der findes en skala for syrer og baser ligesom for alt andet. Her er et par definitioner, som du bør kende:
Syre: En opløsning, der har et overskud af H+-ioner. Det kommer af det latinske ord acidus, som betyder “skarp” eller “sur”.
Base: En base: En opløsning, der har et overskud af OH-ioner. Et andet ord for base er alkali.
Vandig: En opløsning, der hovedsagelig består af vand. Tænk på ordet akvarium. AQUA betyder vand.
Stærk syre: En syre, der har en meget lav pH-værdi (0-4).
Stærk base: En syre, der har en meget lav pH-værdi (0-4).
Stærk base: En base, der har en meget høj pH (10-14).
svag syre: En syre, der kun ioniseres delvist i en vandig opløsning. Det betyder, at ikke alle molekyler går i stykker. Svage syrer har normalt en pH tæt på 7 (3-6).
svag base: En base, der kun delvist ioniseres i en vandig opløsning. Det betyder, at ikke alle molekyler går fra hinanden. Svage baser har normalt en pH tæt på 7 (8-10).
Neutral: En opløsning, der har en pH-værdi på 7. Den er hverken sur eller basisk.
Vi har fortalt dig om ham Arrhenius og hans idéer om koncentrationer af hydrogen- og hydroxidioner. Du skal også lære om Brønsted-Lowry-ideerne. Disse to kemikere fra Danmark og England så på syrer som donorer og baser som acceptorer. Hvad var det, de donerede og accepterede? Hydrogenioner. Det er meget lig den første definition, vi gav, hvor en syre bryder op og frigiver/afgiver en hydrogenion. Denne nyere definition er en smule mere detaljeret. Forskere brugte den nye definition til at beskrive flere baser, som f.eks. ammoniak (NH3). Da baser er protonacceptorer, kunne ammoniak, når man så ammoniak acceptere en H+ og skabe en ammoniumion (NH4+), betegnes som en base. Man behøvede ikke længere at bekymre sig om hydroxidioner. Hvis den fik H+ fra et vandmolekyle, var vandet (H2O) protonedonor. Betyder det, at vandet var syre i denne situation? Ja.
En kemiker ved navn Lewis tilbød en tredje måde at betragte syrer og baser på. I stedet for at se på hydrogenioner kiggede han på elektronpar (kan du huske vores billeder med punktstrukturer i Atomer og grundstoffer?). Ifølge Lewis’ synspunkt accepterer syrer elektronpar, og baser afgiver elektronpar. Vi ved godt, at begge disse beskrivelser af syrer og baser bruger helt modsatte udtryk, men idéen er den samme. Hydrogenioner ønsker stadig at acceptere to elektroner for at danne en binding. Baser ønsker at afgive dem. Samlet set var Lewis’ definition i stand til at klassificere endnu flere forbindelser som syrer eller baser.
Hvad sker der egentlig?
Hvad sker der egentlig i disse opløsninger? Det bliver lidt tricky her. Lad os for en god ordens skyld se på opløsningen af molekyler i vandige (vandbaserede) opløsninger endnu en gang. Syrer er forbindelser, der dissocieres (opløses) i hydrogen (H+)-ioner og en anden forbindelse, når de anbringes i en vandig opløsning. Kan du huske eksemplet med eddikesyre? Baser er forbindelser, der opløses i hydroxidioner (OH-) og en anden forbindelse, når de anbringes i en vandig opløsning. Vi taler om bagepulver om et par stykker.
Lad os ændre ordlyden lidt. Hvis du har en ionisk/elektrovalent forbindelse, og du lægger den i vand, vil den blive splittet op i to ioner. Hvis en af disse ioner er H+, er opløsningen sur. Den stærke syre hydrogenchlorid (HCl) er et eksempel herpå. Hvis en af ionerne er OH-, er opløsningen basisk. Et eksempel på en stærk base er natriumhydroxid (NaOH). Der er andre ioner, der danner sure og basiske opløsninger, men vi vil ikke tale om dem her.
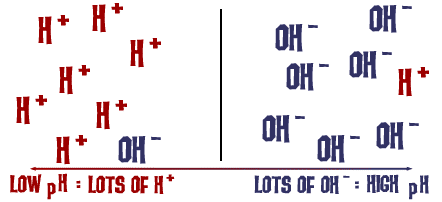
Den pH-skala, vi talte om, er faktisk et mål for antallet af H+-ioner i en opløsning. Hvis der er mange H+-ioner, er pH-værdien meget lav. Hvis der er mange OH-ioner i forhold til antallet af H+-ioner, er pH-værdien høj.
Tænk over denne idé et øjeblik: Hvorfor ville en væske med et højt indhold af NaOH være meget basisk, men samtidig farlig? Na-OH-bindingen brydes i opløsningen, og du har natriumioner (positive) og hydroxidioner (negative). Natriumionerne udgør ikke rigtig nogen fare i opløsningen, men der er et enormt antal hydroxidioner i opløsningen i forhold til de hydrogenioner, der kan flyde rundt som H3O+ (en hydroniumion). alle disse overskydende OH-ioner gør pH-værdien super høj, og opløsningen vil let reagere med mange forbindelser. Det samme sker på en mindre farlig skala, når du tilsætter bagepulver til vand. Under dissociationen frigøres der OH-ioner og kulsyre i opløsningen. Antallet af OH-ioner er større end antallet af H3O+-ioner (H+ og H2O), og pH-værdien stiger. Det er bare ikke så stærk en forskel som i natriumhydroxid.
Det er i princippet det hele. (Ha ha! Forstår du det?)
Mere information i første del.
Relateret video…
Encyclopædia Britannica: Baser
Wikipedia: Wikipedia: Syre
Wikipedia: Baser
Encyclopedia.com: Syrer: Syre
Encyclopedia.com: Syrer
Encyclopedia.com: Acids
Encyclopedia.com: Bases Baser