Lassen Sie uns jetzt das ganze Bild betrachten. Es gibt eine Skala für Säuren und Basen, wie für alles andere auch. Hier sind ein paar Definitionen, die du kennen solltest:
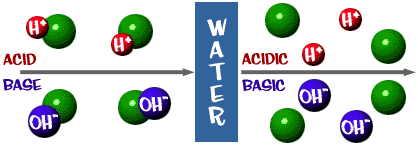
Säure: Eine Lösung, die einen Überschuss an H+-Ionen hat. Es kommt vom lateinischen Wort acidus, das „scharf“ oder „sauer“ bedeutet.
Base: Eine Lösung, die einen Überschuss an OH- Ionen aufweist. Ein anderes Wort für Base ist Alkali.
Wässrig: Eine Lösung, die hauptsächlich aus Wasser besteht. Denke an das Wort Aquarium. AQUA bedeutet Wasser.
Starke Säure: Eine Säure, die einen sehr niedrigen pH-Wert hat (0-4).
Starke Base: Eine Base, die einen sehr hohen pH-Wert hat (10-14).
Schwache Säure: Eine Säure, die in einer wässrigen Lösung nur teilweise ionisiert. Das bedeutet, dass nicht alle Moleküle auseinander brechen. Schwache Säuren haben in der Regel einen pH-Wert nahe bei 7 (3-6).
Schwache Base: Eine Base, die in wässriger Lösung nur teilweise ionisiert. Das bedeutet, dass nicht alle Moleküle auseinander brechen. Schwache Basen haben in der Regel einen pH-Wert nahe bei 7 (8-10).
Neutral: Eine Lösung mit einem pH-Wert von 7. Sie ist weder sauer noch basisch.
Wir haben dir von diesem Arrhenius und seinen Ideen über die Konzentrationen von Wasserstoff- und Hydroxidionen erzählt. Du wirst auch etwas über die Ideen von Brønsted-Lowry lernen. Diese beiden Chemiker aus Dänemark und England betrachteten Säuren als Donatoren und Basen als Akzeptoren. Was gaben sie ab und was nahmen sie auf? Wasserstoff-Ionen. Das ähnelt sehr der ersten Definition, die wir gegeben haben, bei der eine Säure zerfällt und ein Wasserstoffion freisetzt/abgibt. Diese neuere Definition ist ein wenig detaillierter. Wissenschaftler haben die neue Definition verwendet, um mehr Basen zu beschreiben, wie z. B. Ammoniak (NH3). Da Basen Protonenakzeptoren sind, konnte Ammoniak, wenn es ein H+ aufnimmt und ein Ammoniumion (NH4+) bildet, als Base bezeichnet werden. Man brauchte sich nicht mehr um Hydroxidionen zu kümmern. Wenn es das H+ von einem Wassermolekül erhielt, dann war das Wasser (H2O) der Protonendonator. Bedeutet das, dass das Wasser in dieser Situation die Säure war? Ja.
Ein Chemiker namens Lewis bot einen dritten Weg an, Säuren und Basen zu betrachten. Er betrachtete nicht die Wasserstoffionen, sondern die Elektronenpaare (erinnern Sie sich an unsere Bilder mit den Punktstrukturen in Atome und Elemente?). Nach Lewis‘ Ansicht nehmen Säuren Elektronenpaare auf und Basen geben Elektronenpaare ab. Wir wissen, dass diese beiden Beschreibungen von Säuren und Basen völlig gegensätzliche Begriffe verwenden, aber die Idee ist dieselbe. Wasserstoffionen wollen immer noch zwei Elektronen aufnehmen, um eine Bindung einzugehen. Basen wollen sie abgeben. Insgesamt konnten mit der Lewis-Definition noch mehr Verbindungen als Säuren oder Basen klassifiziert werden.
Was passiert wirklich?
Was passiert wirklich in diesen Lösungen? Hier wird es ein wenig knifflig. Schauen wir uns noch einmal den Zerfall von Molekülen in wässrigen (wasserbasierten) Lösungen an, um sicherzugehen. Säuren sind Verbindungen, die in einer wässrigen Lösung in Wasserstoff (H+)-Ionen und eine andere Verbindung dissoziieren (zerfallen). Erinnern Sie sich an das Beispiel der Essigsäure? Basen sind Verbindungen, die in Hydroxid (OH-)-Ionen und eine andere Verbindung zerfallen, wenn sie in eine wässrige Lösung gegeben werden. Wir werden in ein paar Absätzen über Backpulver sprechen.
Lassen Sie uns die Formulierung ein wenig ändern. Wenn man eine ionische/elektrovalente Verbindung hat und sie in Wasser gibt, zerfällt sie in zwei Ionen. Wenn eines dieser Ionen H+ ist, ist die Lösung sauer. Die starke Säure Chlorwasserstoff (HCl) ist ein Beispiel dafür. Wenn eines der Ionen OH- ist, ist die Lösung basisch. Ein Beispiel für eine starke Base ist Natriumhydroxid (NaOH). Es gibt noch andere Ionen, die saure und basische Lösungen bilden, aber über die werden wir hier nicht sprechen.
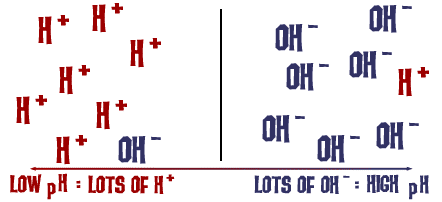
Die pH-Skala, über die wir gesprochen haben, ist eigentlich ein Maß für die Anzahl der H+-Ionen in einer Lösung. Wenn es viele H+-Ionen gibt, ist der pH-Wert sehr niedrig. Wenn es im Vergleich zu den H+-Ionen viele OH–Ionen gibt, ist der pH-Wert hoch.
Denken Sie kurz darüber nach: Warum sollte eine Flüssigkeit mit einem hohen Anteil an NaOH sehr basisch und gleichzeitig gefährlich sein? Die Na-OH-Bindung bricht in Lösung auf und es entstehen Natriumionen (positiv) und Hydroxidionen (negativ). Die Natriumionen stellen in Lösung keine wirkliche Gefahr dar, aber im Vergleich zu den Wasserstoffionen, die als H3O+ (ein Hydronium-Ion) in der Lösung herumschwimmen, gibt es eine große Anzahl von Hydroxid-Ionen, die den pH-Wert sehr hoch ansteigen lassen, so dass die Lösung leicht mit vielen Verbindungen reagiert. Das Gleiche passiert in einem weniger gefährlichen Ausmaß, wenn man Backpulver zu Wasser hinzufügt. Bei der Dissoziation werden OH–Ionen und Kohlensäure in der Lösung freigesetzt. Die Anzahl der OH–Ionen ist größer als die Anzahl der H3O+-Ionen (H+ und H2O), und der pH-Wert steigt an. Der Unterschied ist nur nicht so stark wie bei Natriumhydroxid.
Das ist es im Grunde. (Ha ha! Verstehst du?)
Mehr Informationen im ersten Teil.
Verwandtes Video…
Encyclopædia Britannica: Basen
Wikipedia: Säuren
Wikipedia: Basen
Encyclopedia.com: Säuren
Encyclopedia.com: Basen