Laten we nu eens naar het hele plaatje kijken. Er is een schaal voor zuren en basen, net als voor alles. Hier zijn een paar definities die u moet weten:
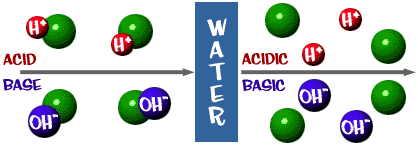
Zuur: Een oplossing met een overmaat aan H+ ionen. Het komt van het Latijnse woord acidus, dat “scherp” of “zuur” betekent.
Base: Een oplossing die een overmaat aan OH- ionen heeft. Een ander woord voor base is alkali.
Aqueus: Een oplossing die voornamelijk uit water bestaat. Denk maar aan het woord aquarium. AQUA betekent water.
Zwaar zuur: Een zuur dat een zeer lage pH heeft (0-4).
Zware base: Een base die een zeer hoge pH heeft (10-14).
Zwak zuur: Een zuur dat slechts gedeeltelijk ioniseert in een waterige oplossing. Dit betekent dat niet elk molecuul uit elkaar valt. Zwakke zuren hebben meestal een pH dicht bij 7 (3-6).
Zwakke base: Een base die slechts gedeeltelijk ioniseert in een waterige oplossing. Dit betekent dat niet elk molecuul uit elkaar valt. Zwakke basen hebben meestal een pH dicht bij 7 (8-10).
Neutraal: Een oplossing die een pH heeft van 7. Ze is noch zuur noch basisch.
We hebben je verteld over die man Arrhenius en zijn ideeën over concentraties van waterstof- en hydroxide-ionen. Je gaat ook leren over de ideeën van Brønsted-Lowry. Deze twee scheikundigen uit Denemarken en Engeland keken naar zuren als donors en basen als acceptors. Wat waren ze aan het doneren en accepteren? Waterstofionen. Het lijkt veel op de eerste definitie die we gaven, waarbij een zuur uiteenvalt en een waterstofion vrijgeeft/schenkt. Deze nieuwe definitie is een beetje gedetailleerder. Wetenschappers gebruikten de nieuwe definitie om meer basen te beschrijven, zoals ammoniak (NH3). Aangezien basen protonen accepteren, kon ammoniak, als het een H+ accepteert en een ammoniumion (NH4+) aanmaakt, als een base worden bestempeld. Je hoefde je geen zorgen meer te maken over hydroxide-ionen. Als het de H+ van een watermolecuul kreeg, dan was het water (H2O) de proton-donor. Betekent dit dat het water in deze situatie het zuur was? Ja.
Een chemicus genaamd Lewis stelde een derde manier voor om naar zuren en basen te kijken. In plaats van te kijken naar waterstofionen, keek hij naar elektronenparen (herinner je je onze plaatjes met puntstructuren in Atomen en Elementen?). Volgens Lewis accepteren zuren elektronenparen en staan basen elektronenparen af. We weten dat in beide beschrijvingen van zuren en basen volledig tegengestelde termen worden gebruikt, maar het idee is hetzelfde. Waterstofionen willen nog steeds twee elektronen accepteren om een binding te vormen. Basen willen ze afstaan. Over het geheel genomen konden met de definitie van Lewis nog meer verbindingen als zuren of basen worden geclassificeerd.
Wat gebeurt er nu echt?
Wat gebeurt er nu echt in die oplossingen? Hier wordt het een beetje lastig. Laten we voor de zekerheid nog eens kijken naar het uiteenvallen van moleculen in waterige (op water gebaseerde) oplossingen. Zuren zijn verbindingen die dissociëren (breken) in waterstof (H+) ionen en een andere verbinding wanneer ze in een waterige oplossing worden geplaatst. Herinner je je het voorbeeld van azijnzuur nog? Basen zijn verbindingen die uiteenvallen in hydroxide (OH-) ionen en een andere verbinding wanneer ze in een waterige oplossing worden gebracht. Over zuiveringszout zullen we het zo hebben.
Laten we de formulering een beetje veranderen. Als je een ionische/elektro-valente verbinding hebt en je stopt die in water, dan zal die uiteenvallen in twee ionen. Als een van die ionen H+ is, is de oplossing zuur. Het sterke zuur waterstofchloride (HCl) is een voorbeeld. Als een van de ionen OH- is, is de oplossing basisch. Een voorbeeld van een sterke base is natriumhydroxide (NaOH). Er zijn nog andere ionen die zure en basische oplossingen maken, maar daar zullen we het hier niet over hebben.
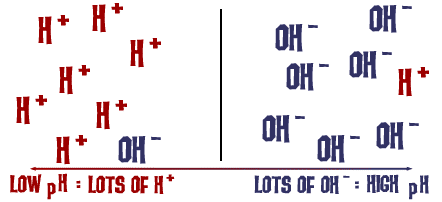
Die pH-schaal waar we het over hadden is eigenlijk een maat voor het aantal H+ ionen in een oplossing. Als er veel H+ ionen zijn, is de pH erg laag. Als er veel OH- ionen zijn in verhouding tot het aantal H+ ionen, is de pH hoog.
Denk eens even na over dit idee: waarom zou een vloeistof met veel NaOH zeer basisch zijn, maar tegelijkertijd gevaarlijk? De Na-OH-binding verbreekt in oplossing en je hebt natriumionen (positief) en hydroxide-ionen (negatief). De natriumionen vormen in oplossing niet echt een gevaar, maar er zijn enorm veel hydroxide-ionen in oplossing vergeleken met de waterstofionen die als H3O+ (een hydroniumion) kunnen rondzweven. Al die overtollige OH- ionen maken de pH superhoog, en de oplossing zal gemakkelijk reageren met veel verbindingen. Hetzelfde gebeurt op een minder gevaarlijke schaal wanneer je zuiveringszout aan water toevoegt. Bij de dissociatie komen OH- ionen en koolzuur vrij in de oplossing. Het aantal OH- ionen is groter dan het aantal H3O+ ionen (H+ en H2O), en de pH stijgt. Het is alleen niet zo’n sterk verschil als bij natriumhydroxide.
Dat is het eigenlijk. (Ha ha! Snap je het?)
Meer informatie in deel één.
Gerelateerde Video…
Encyclopædia Britannica: Bases
Wikipedia: Zuren
Wikipedia: Bases
Encyclopedia.com: Acids
Encyclopedia.com: Bases