Lernziele
- Identifizieren Sie Alkane, Alkene, Alkine und aromatische Verbindungen.
- Nenne einige Eigenschaften von Kohlenwasserstoffen.
Die einfachsten organischen Verbindungen bestehen aus nur zwei Elementen: Kohlenstoff und Wasserstoff. Diese Verbindungen werden als Kohlenwasserstoffe bezeichnet. Die Kohlenwasserstoffe selbst werden in zwei Arten unterteilt: aliphatische Kohlenwasserstoffe und aromatische Kohlenwasserstoffe. Aliphatische Kohlenwasserstoffe sind Kohlenwasserstoffe, die auf Ketten von C-Atomen basieren. Es gibt drei Arten von aliphatischen Kohlenwasserstoffen. Alkane sind aliphatische Kohlenwasserstoffe mit nur einfachen kovalenten Bindungen. Alkene sind aliphatische Kohlenwasserstoffe, die mindestens eine C-C-Doppelbindung enthalten, und Alkine sind aliphatische Kohlenwasserstoffe, die eine C-C-Dreifachbindung enthalten. Gelegentlich findet man einen aliphatischen Kohlenwasserstoff mit einem Ring aus C-Atomen; diese Kohlenwasserstoffe werden Cycloalkane (oder Cycloalkene oder Cycloalkine) genannt.
Aromatische Kohlenwasserstoffe, wie Benzol, sind flache Ringsysteme, die kontinuierlich überlappende p-Orbitale enthalten.Elektronen im Benzolring haben besondere energetische Eigenschaften, die Benzol physikalische und chemische Eigenschaften verleihen, die sich deutlich von denen der Alkane unterscheiden. Ursprünglich wurde diese Verbindungsklasse als aromatisch bezeichnet, weil sie besonders wohlriechend sind. In der modernen Chemie bezeichnet der Begriff aromatisch jedoch das Vorhandensein eines sehr stabilen Rings, der einem Molekül unterschiedliche und einzigartige Eigenschaften verleiht.
Bei den einfachsten Alkanen sind die C-Atome in einer geraden Kette gebunden; diese werden als normale Alkane bezeichnet. Sie werden nach der Anzahl der C-Atome in der Kette benannt. Das kleinste Alkan ist Methan:
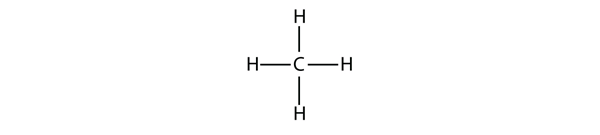
Abbildung 16.1 Dreidimensionale Darstellung von Methan

Um vier kovalente Bindungen zu bilden, verbindet sich das C-Atom mit vier H-Atomen, was die Molekularformel für Methan CH4 ergibt. Das zweidimensionale Diagramm für Methan ist jedoch irreführend; die vier kovalenten Bindungen, die das C-Atom eingeht, sind dreidimensional auf die Ecken eines Tetraeders ausgerichtet. Eine bessere Darstellung des Methanmoleküls ist in Abbildung 16.1 „Dreidimensionale Darstellung von Methan“
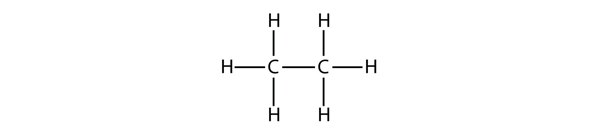
Das nächstgrößere Alkan hat zwei C-Atome, die kovalent aneinander gebunden sind. Damit jedes C-Atom vier kovalente Bindungen eingehen kann, muss jedes C-Atom an drei H-Atome gebunden sein. Das resultierende Molekül mit der Formel C2H6 ist Ethan:
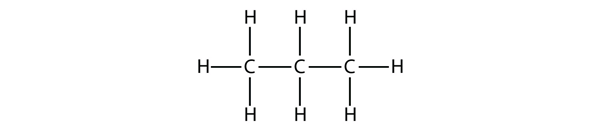
Propan hat ein Rückgrat aus drei C-Atomen, die von H-Atomen umgeben sind. Du solltest in der Lage sein zu überprüfen, dass die Summenformel für Propan C3H8 ist:
Die Diagramme, die wir bisher gesehen haben und die Alkane darstellen, sind recht einfache Lewis-Strukturen. Wenn die Moleküle jedoch größer werden, werden die Lewis-Strukturen immer komplexer. Eine Möglichkeit, dies zu umgehen, ist die Verwendung einer kondensierten Struktur, in der die Formeln der einzelnen C-Atome im Rückgrat des Moleküls aufgeführt sind. So lautet die kondensierte Struktur für Ethan beispielsweise CH3CH3, während sie für Propan CH3CH2CH3 lautet. Tabelle 16.1 „Die ersten 10 Alkane“ enthält die Summenformeln, die kondensierten Strukturformeln und die Namen der ersten 10 Alkane.
Tabelle 16.1 Die ersten 10 Alkane
| Molekulare Formel | Kondensierte Strukturformel | Name |
|---|---|---|
| CH4 | CH4 | Methan |
| C2H6 | CH3CH3 | Ethan |
| C3H8 | CH3CH2CH3 | Propan |
| C4H10 | CH3CH2CH2CH3 | Butan |
| C5H12 | CH3CH2CH2CH2CH3 | Pentan |
| C6H14 | CH3(CH2)4CH3 | Hexan |
| C7H16 | CH3(CH2)5CH3 | Heptan |
| C8H18 | CH3(CH2)6CH3 | Oktan |
| C9H20 | CH3(CH2)7CH3 | Nonan |
| C10H22 | CH3(CH2)8CH3 | Decan |
Da Alkane die nach den Regeln der kovalenten Bindung maximal mögliche Anzahl von H-Atomen besitzen, werden Alkane auch als gesättigte Kohlenwasserstoffe bezeichnet.
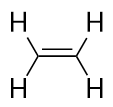
Alkane haben eine C-C-Doppelbindung. Da sie weniger als die maximal mögliche Anzahl von H-Atomen haben, werden sie als ungesättigte Kohlenwasserstoffe bezeichnet. Das kleinste Alken – Eten – hat zwei C-Atome und ist auch unter seinem gebräuchlichen Namen Ethylen bekannt:
Das nächstgrößere Alken – Propen – hat drei C-Atome mit einer C-C-Doppelbindung zwischen zwei der C-Atome. Es wird auch Propylen genannt:
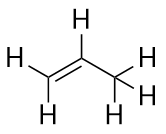
Was fällt dir an den Namen von Alkanen und Alkenen auf? Die Namen der Alkene sind die gleichen wie die der entsprechenden Alkane, außer dass das Suffix (die Endung) -ene und nicht -ane ist. Wie wir noch sehen werden, ist es in der organischen Chemie üblich, einen Stamm zu verwenden, der als Stammkette bekannt ist, um die Anzahl der C-Atome in einem Molekül anzugeben, und eine Endung, um die Art der organischen Verbindung darzustellen.
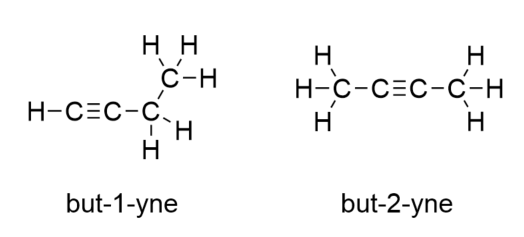
Mit der Einführung des nächsten Alkens, des Butens, beginnen wir, ein großes Problem mit organischen Molekülen zu sehen: die Auswahlmöglichkeiten. Bei vier C-Atomen kann die C-C-Doppelbindung zwischen dem ersten und dem zweiten C-Atom oder zwischen dem zweiten und dem dritten C-Atom verlaufen:
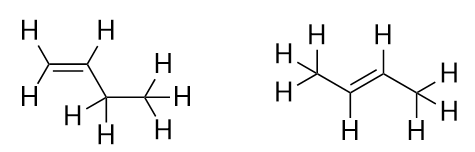
(Eine Doppelbindung zwischen dem dritten und dem vierten C-Atom ist dasselbe wie zwischen dem ersten und dem zweiten C-Atom, nur umgedreht.) Die Benennungsregeln der organischen Chemie verlangen, dass diese beiden Stoffe unterschiedliche Namen haben. Das erste Molekül wird But-1-en genannt, das zweite Molekül But-2-en. Die Zahl zwischen dem Namen der Stammkette und dem Suffix wird als Lokant bezeichnet und gibt an, an welchem Kohlenstoff die Doppelbindung entsteht. Die kleinstmögliche Zahl wird verwendet, um ein Merkmal in einem Molekül zu nummerieren; daher wäre es falsch, das zweite Molekül but-3-en zu nennen. Zahlen sind übliche Bestandteile von organisch-chemischen Namen, weil sie angeben, welches C-Atom in einer Kette ein Unterscheidungsmerkmal enthält. Wenn sich die Doppelbindung (oder eine andere funktionelle Gruppe) am ersten Kohlenstoffatom befindet, ist es bei manchen Autoren üblich, den Lokanten wegzulassen. Wenn zum Beispiel Buten ohne Lokant geschrieben wird, sollte man davon ausgehen, dass es sich um But-1-en und nicht um But-2-en handelt.
Die Verbindungen But-1-en und But-2-en haben unterschiedliche physikalische und chemische Eigenschaften, obwohl sie die gleiche Summenformel haben – C4H8. Verschiedene Moleküle mit der gleichen Summenformel werden als Isomere bezeichnet. Isomere sind in der organischen Chemie häufig anzutreffen und tragen zu ihrer Komplexität bei.
Beispiel 1
Schlage auf der Grundlage der Namen für die Butenmoleküle einen Namen für dieses Molekül vor.
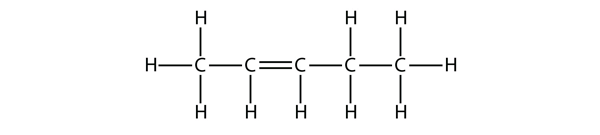
Lösung
Mit fünf C-Atomen verwenden wir den Namen des Pentens, und mit einer C-C-Doppelbindung ist es ein Alken, also ist dieses Molekül ein Penten. Bei der Nummerierung der C-Atome verwenden wir die Zahl 2, weil sie die niedrigste mögliche Bezeichnung ist. Dieses Molekül wird also Pent-2-en genannt.
Teste dich selbst
Schlage auf der Grundlage der Namen für die Butenmoleküle einen Namen für dieses Molekül vor.
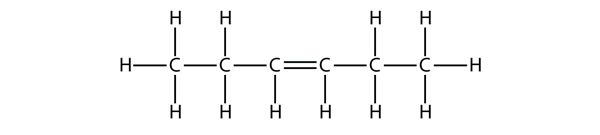
Antwort
Hex-3-en
Alkine, mit einer C-C-Dreifachbindung, werden ähnlich wie Alkene benannt, außer dass ihre Namen auf -yne enden. Das kleinste Alkin ist Ethin, das auch als Acetylen bekannt ist:
![]()
Propyne hat diese Struktur:
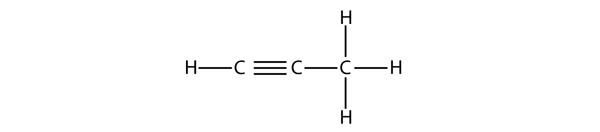
Bei Butin müssen wir mit der Nummerierung der Position der Dreifachbindung beginnen, genau wie bei den Alkenen:
Benzol ist eine aromatische Verbindung, die aus sechs C-Atomen in einem Ring besteht, mit abwechselnden einfachen und doppelten C-C-Bindungen:
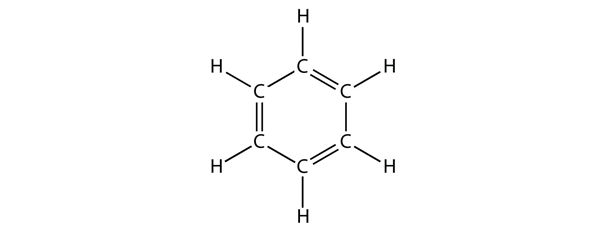
Die abwechselnden einfachen und doppelten C-C-Bindungen verleihen dem Benzolring eine besondere Stabilität, und er reagiert nicht wie ein Alken, wie man vielleicht erwarten würde.
So grundlegend Kohlenwasserstoffe für die organische Chemie sind, so alltäglich sind ihre Eigenschaften und chemischen Reaktionen. Die meisten Kohlenwasserstoffe sind unpolar, da die Elektronegativität der C- und H-Atome nahe beieinander liegt. Daher lösen sie sich nur in geringem Maße in H2O und anderen polaren Lösungsmitteln. Kleine Kohlenwasserstoffe wie Methan und Ethan sind bei Raumtemperatur gasförmig, während größere Kohlenwasserstoffe wie Hexan und Oktan flüssig sind. Noch größere Kohlenwasserstoffe, wie Hentriacontan (C31H64), sind bei Raumtemperatur fest und haben eine weiche, wachsartige Konsistenz.
Kohlenwasserstoffe sind eher reaktionslos, nehmen aber an einigen klassischen chemischen Reaktionen teil. Eine häufige Reaktion ist die Substitution mit einem Halogenatom durch die Kombination eines Kohlenwasserstoffs mit einem elementaren Halogen. Manchmal wird Licht verwendet, um die Reaktion zu fördern, wie bei dieser Reaktion zwischen Methan und Chlor:
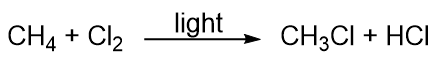
Halogene können auch mit Alkenen und Alkinen reagieren, aber die Reaktion ist anders. In diesen Fällen reagieren die Halogenmoleküle mit der C-C-Doppel- oder Dreifachbindung und lagern sich an jedes C-Atom an, das an den Mehrfachbindungen beteiligt ist. Diese Reaktion wird als Additionsreaktion bezeichnet. Ein Beispiel ist
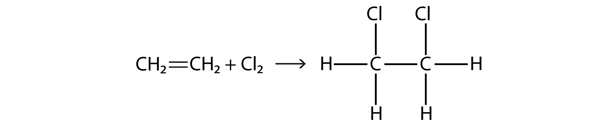
Die Reaktionsbedingungen sind in der Regel mild; in vielen Fällen reagiert das Halogen spontan mit einem Alken oder einem Alkin.
Wasserstoff kann auch über eine Mehrfachbindung hinzugefügt werden; diese Reaktion wird Hydrierungsreaktion genannt. In diesem Fall sind die Reaktionsbedingungen jedoch nicht unbedingt mild; es können hohe Drücke von H2-Gas erforderlich sein. In der Regel wird ein Platin- oder Palladiumkatalysator verwendet, um die Reaktion in einem angemessenen Tempo ablaufen zu lassen:
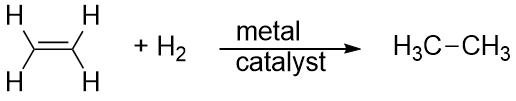
Die bei weitem häufigste Reaktion von Kohlenwasserstoffen ist die Verbrennung, d. h. die Kombination eines Kohlenwasserstoffs mit O2, wobei CO2 und H2O entstehen. Die Verbrennung von Kohlenwasserstoffen geht mit der Freisetzung von Energie einher und ist eine Hauptquelle der Energieerzeugung in unserer Gesellschaft (Abbildung 16.2 „Verbrennung“). Die Verbrennungsreaktion für Benzin zum Beispiel, das durch C8H18 dargestellt werden kann, läuft wie folgt ab:
2 C8H18 + 25 O2 → 16 CO2 + 18 H2O + ~5060 kJ
Abbildung 16.2 Verbrennung
