ABSTRACT: Die verfügbaren antiretroviralen (ARV) Medikamente zur Behandlung von HIV haben sich seit 2018 erweitert. Es wurden neuartige ARVs mit neuen Wirkmechanismen zugelassen, darunter Ibalizumab-uiyk und Fostemsavir. Außerdem wurden Kombinationstabletten mit bereits verfügbaren Medikamenten zugelassen, wie Bictegravir/Emtricitabin/Tenofovirafenamid und Dolutegravir/Lamivudin. Schließlich gab es eine Ausweitung der zugelassenen Indikationen für bereits verfügbare ARV selbst, wie z. B. Emtricitabin/Tenofovir Alafenamid für die Verwendung in der Präexpositionsprophylaxe.
US Pharm. 2020:45(10):17-25.
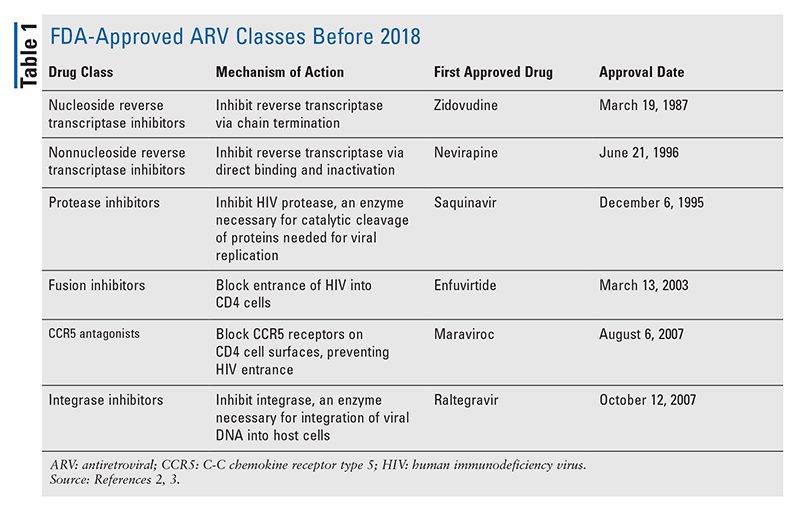
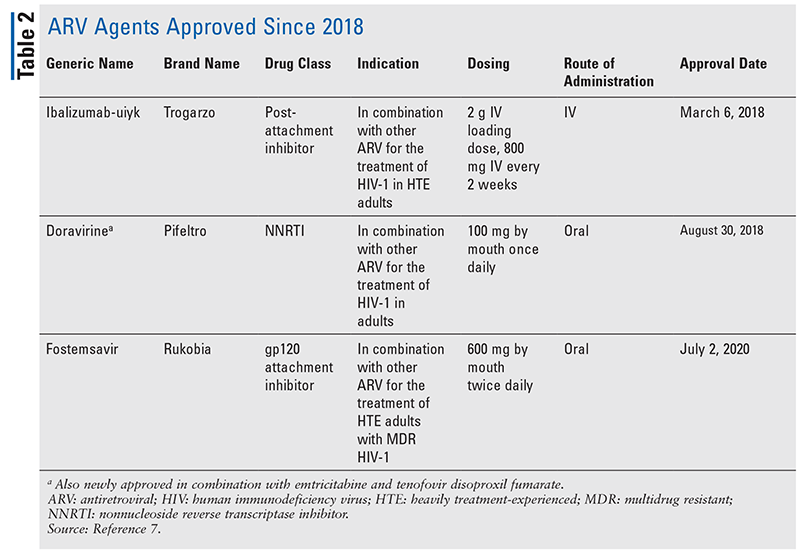
Die wichtigsten antiretroviralen (ARV) Wirkstoffe für die Behandlung von HIV bestehen seit Jahren größtenteils aus der gleichen Handvoll Arzneimittelklassen. Die HIV-Behandlung wurde zunächst mit nukleosidischen Reverse-Transkriptase-Inhibitoren (NRTIs), der ersten von der FDA zugelassenen Klasse von ARVs, versucht. Nach und nach wurden immer mehr Wirkstoffklassen entdeckt und für die Behandlung in verschiedenen, oft komplexen Therapieschemata zur Verfügung gestellt (TABELLE 1).1-3 Nach der Zulassung von Raltegravir im Jahr 2007 wurden neue HIV-Medikamente vor allem für bereits verfügbare Medikamente und neue Kombinationspräparate zugelassen. Dies änderte sich 2018 mit der Zulassung von Ibalizumab-uiyk, dem ersten neuen ARV seit über einem Jahrzehnt.4 Auf Ibalizumab-uiyk folgten im selben Jahr ein neuer nicht-nukleosidischer Reverse-Transkriptase-Hemmer (NNRTI), Doravirin, und 2020 ein neuartiger Bindungsinhibitor, Fostemsavir (TABELLE 2).5-7
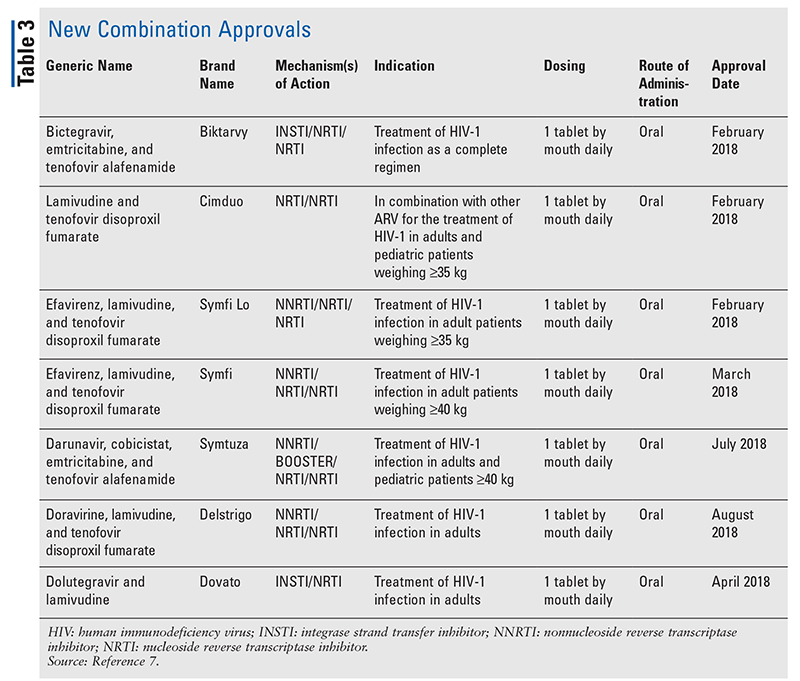
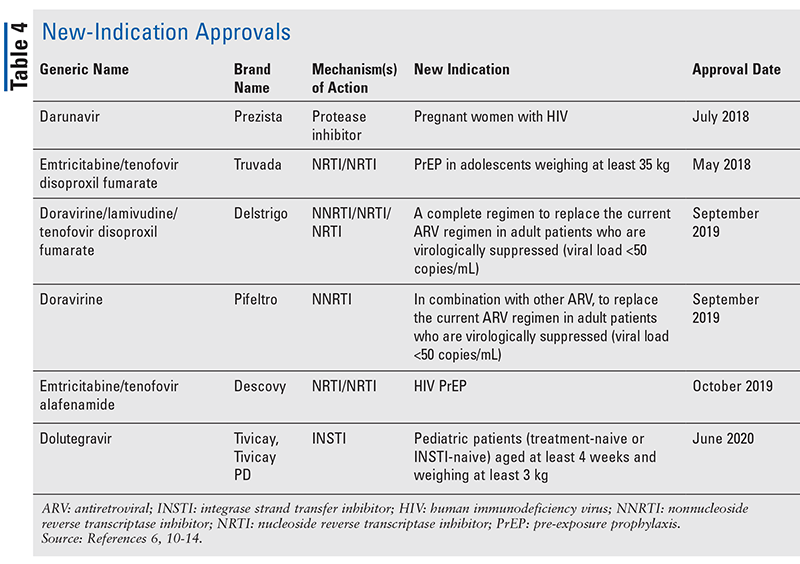
Während neuartige Medikamente oft die aufregendsten neuen Arzneimittelzulassungen sind, haben sich ARVs auch in anderer Hinsicht verbessert. Angesichts der enormen Pillenlast vieler HIV-Therapien können neu zugelassene ARV-Kombinationen (TABELLE 3) das Leben der Patienten erheblich erleichtern. Die Verwendung solcher Wirkstoffe und die Begrenzung der notwendigen Pillenlast haben nachweislich die Therapietreue und die Gesamtergebnisse verbessert.8,9 Es gab auch Erweiterungen der zugelassenen Indikationen für bereits verfügbare ARVs (TABELLE 4), die neue Optionen für bestimmte Patientengruppen und Indikationen bieten.10-14
Obwohl es seit 2018 viele neue Zulassungen gibt, werden in diesem Artikel vier der neu zugelassenen Medikamente und eine neue Indikation vorgestellt. Diese Zulassungen wurden ausgewählt, um einen Ausschnitt aus der großen Vielfalt neuer Wirkstoffe zu zeigen und einige neue Optionen hervorzuheben, die eine einzigartige Chance für die Behandlung von HIV bieten.
Ibalizumab-Uiyk (Trogarzo)
Ibalizumab-uiyk ist ein injizierbarer rekombinanter monoklonaler Antikörper, der an die Oberflächenproteine von CD4-Zellen bindet, was zu Konformationsänderungen führt, die die für die HIV-1-Fusion und den Eintritt in die Zelle erforderlichen Schritte nach der Anheftung verhindern. Es ist das einzige monoklonale Medikament, das bei der Behandlung von HIV eingesetzt wird. Aufgrund seiner einzigartigen Bindungsspezifität blockiert Ibalizumab-uiyk den Eintritt des Virus in die Zelle, ohne eine Immunsuppression zu verursachen, was bei vielen monoklonalen Medikamenten ein Problem darstellt.4,15 Es ist in Kombination mit anderen ARVs zur Behandlung von schwer behandlungserfahrenen (HTE) Erwachsenen mit multiresistentem (MDR) HIV-1 indiziert, bei denen das derzeitige ARV-Therapieschema versagt.4
Die Zulassung von Ibalizumab-uiyk basierte auf einer Studie, die an 40 HTE-HIV-Patienten mit einer Viruslast von mehr als 1.000 Kopien/ml und einer dokumentierten Resistenz gegen mindestens einen NRTI, NNRTI und einen Proteaseinhibitor durchgeführt wurde. Die Patienten mussten außerdem mindestens 6 Monate lang behandelt worden sein und vor kurzem eine Therapie abgebrochen haben. Die Studie umfasste drei Phasen, beginnend mit einer 6-tägigen Phase, in der die Ausgangsviruslast ermittelt und bestätigt wurde (Kontrollphase). Am Tag 7 erhielten die Patienten zusätzlich zu ihrer Standard-ART-Behandlung eine 2 000-mg-Ladedosis Ibalizumab-uiyk (funktionelle Monotherapie). Am 14. Tag wurde die Viruslast erneut bestimmt, und die Therapien wurden überwacht und angepasst, um eine angemessene Wirkung gegen die HIV-Infektion zu gewährleisten. Ibalizumab-uiyk 800 mg wurde alle 2 Wochen bis zum Abschluss der Studie (Erhaltungsphase) intravenös verabreicht. Als primärer Endpunkt wurde der Unterschied im Anteil der Verringerung der Viruslast zwischen dem Kontrollzeitraum und dem Zeitraum der funktionellen Monotherapie bewertet, wobei insbesondere der Prozentsatz der Patienten mit einem Rückgang der Gesamtviruslast um ³0,5 log10 verglichen wurde. Während des Kontrollzeitraums wurde bei 3 % der Patienten ein solcher Rückgang festgestellt, während im Zeitraum der funktionellen Monotherapie 83 % der Patienten die angegebene Verringerung der Viruslast erreichten. Am Ende von 25 Wochen erreichten 43 % der Patienten eine Viruslast von <50 Kopien/ml.16
Auf der Grundlage dieser Studie ist die zugelassene Dosierung von Ibalizumab-uiyk eine einmalige IV-Ladedosis von 2.000 mg, gefolgt von einer 800-mg-IV-Erhaltungsdosis alle 2 Wochen.4,16 Eine sorgfältige Überwachung ist für 1 Stunde nach Verabreichung der ersten Infusion für infusionsbedingte Reaktionen erforderlich, wobei die nachfolgende Infusionsüberwachung auf 15 Minuten nach Verabreichung der ersten Dosis reduziert wird.4 Ibalizumab-uiyk scheint ansonsten gut verträglich zu sein; die meisten unerwünschten Wirkungen im Zusammenhang mit Ibalizumab-uiyk waren Übelkeit, Schwindel und Durchfall.4,16
Fostemsavir (Rukobia)
Fostemsavir ist ein neuartiges ARV, das für die Kombinationstherapie bei erwachsenen HTE-Patienten mit bekanntem MDR-HIV-1 indiziert ist, insbesondere bei Patienten, bei denen die derzeitige ART aufgrund potenzieller Resistenz, Unverträglichkeit oder Sicherheitsbedenken versagt.4 Es ist der erste von der FDA zugelassene Bindungsinhibitor. Nach enzymatischer Aktivierung zum aktiven Molekül Temsavir bindet es an gp120, ein virales Hüllenglykoprotein, das für die Anheftung des Virus an CD4-Zellen notwendig ist. Dadurch wird das Eindringen des Virus in CD4-Zellen verhindert und die Virusreplikation wirksam gestoppt. Aufgrund dieses neuartigen Mechanismus ist es unwahrscheinlich, dass Fostemsavir durch den selektiven Druck, der mit den meisten anderen ARV verbunden ist, eine Resistenz gegen sich selbst hervorruft.6,17
Fostemsavir wurde in einer randomisierten, doppelblinden, placebokontrollierten klinischen Studie (BRIGHTE) mit 371 HTE-HIV-1-Patienten auf Sicherheit und Wirksamkeit untersucht.16,17 Die Patienten der Hauptkohorte wurden insgesamt 8 Tage lang entweder mit ihrem ART-Basisregime und Fostemsavir 600 mg zweimal täglich oder mit Placebo behandelt. Bei der Bewertung an Tag 8 zeigten die Fostemsavir-Patienten signifikant niedrigere Serumspiegel der viralen HIV-RNA. Nach diesem ersten Behandlungszeitraum wurden alle Patienten auf zweimal täglich 600 mg Fostemsavir umgestellt. Nach 24 Wochen erreichten 53 % der Studienteilnehmer eine effektive, nicht nachweisbare Virussuppression, wobei sich die Suppression in Woche 96 auf 60 % verbesserte.17,18
Die am häufigsten berichtete unerwünschte Wirkung von Fostemsavir war Übelkeit. Schwerwiegendere Reaktionen, einschließlich Erhöhungen der Leberenzyme, wurden bei Patienten mit Hepatitis-B- oder Hepatitis-C-Koinfektion berichtet.17,18 Andere Studien berichteten über ein geringeres Auftreten von Kopfschmerzen, Hautausschlag und Durchfall. Der aktive Metabolit Temsavir wird durch CYP3A4 metabolisiert, daher sollten starke Induktoren wie Carbamazepin, Rifampin und Johanniskraut vermieden werden, um eine verringerte Serum-Temsavir-Konzentration zu verhindern.17-19
Bictegravir/Emtricitabin/Tenofovir-Alafenamid (Biktarvy)
Bictegravir/Emtricitabin/Tenofovir-Alafenamid (BIC/FTC/TAF) ist eine fest dosierte, einmal täglich einzunehmende Kombinationstablette, die einen neuartigen Integrase-Inhibitor und zwei Nukleosid/Nukleotid-Reverse-Transkriptase-Inhibitoren enthält. Die einzelnen Bestandteile von Biktarvy sind Bictegravir 50 mg (ein Integrase-Strangübertragungshemmer), Emtricitabin 200 mg (ein NRTI) und Tenofovirafenamid 25 mg (ein NRTI). BIC/FTC/TAF ist als komplettes Therapieschema für HIV-1-infizierte Erwachsene ohne ART in der Vorgeschichte oder als Ersatz für das derzeitige ART-Regime von Patienten indiziert, die virologisch unterdrückt sind (Viruslast £50 Kopien pro ml) und seit mindestens drei Monaten ein stabiles ARV-Regime erhalten und bei denen kein Behandlungsversagen oder eine Resistenz gegen die einzelnen Komponenten vorliegt. Besonders wichtig ist, dass es sich um ein komplettes Regime mit nur einer Tablette handelt, das keine anderen ARVs erfordert.20
BIC/FTC/TAF wurde 2018 nach vier klinischen Studien zugelassen. Zwei der klinischen Studien untersuchten die Wirksamkeit und Sicherheit von BIC/FTC/TAF bei Patienten, die keine ART in der Vorgeschichte hatten: Studie 1489 (randomisiert, BIC/FTC/TAF vs. Abacavir/Dolutegravir/Lamivudin, und Studie 1490 (randomisiert, BIC/FTC/TAF vs. Dolutegravir + Emtricitabin/Tenofovir Alafenamid).21,22 In der Studie 1489 wurde der primäre Endpunkt einer Viruslast <50 Kopien/ml bei 92 % der BIC/FTC/TAF-Gruppe und 93 % der ABC/DTG/3TC-Gruppe erreicht (Behandlungsunterschied von -0,6 %; 95 % Konfidenzintervall, -4,8 % bis 3,6 %). In der Studie 1490 wurde der primäre Endpunkt einer Viruslast <50 Kopien/ml bei 89 % der BIC/FTC/TAF-Gruppe und 93 % der DTG + FTC/TAF-Gruppe erreicht (Behandlungsunterschied von -3,5 %; 95 % CI, -7,9 % bis 1,0 %).21,22
Die beiden anderen Studien untersuchten die Wirksamkeit und Sicherheit von BIC/FTC/TAF bei virologisch unterdrückten Patienten, die von ihren derzeitigen ART-Schemata auf BIC/FTC/TAF umgestellt werden sollten: Studie 1844 (randomisierte Umstellung von Dolutegravir plus Abacavir/Lamivudin oder ABC/DTG/3TC auf BIC/FTC/TAF) und Studie 1878 (offene Umstellung von Atazanavir oder verstärktem Darunavir plus Abacavir/Emtricitabin oder Emtricitabin/Tenofovir Disoproxil Fumarat auf BIC/FTC/TAF).23,24 In der Studie 1844 wurde der primäre Endpunkt, d. h. der Verlust der virologischen Suppression (Viruslast ³50 Kopien pro ml), bei 1 % der Patienten in der BIC/FTC/TAF-Gruppe und bei <1 % der Patienten in der ursprünglichen Behandlungsgruppe beobachtet (Behandlungsunterschied von 0,7 %, 95 % CI, -1,0 % bis 2,8 %). In der Studie 1878 wurde der primäre Endpunkt, d. h. der Verlust der virologischen Suppression, bei 2 % der BIC/FTC/TAF-Gruppe und 2 % der Gruppe mit dem ursprünglichen Regime beobachtet (Behandlungsunterschied von 0,0 %; 95 % KI, -2,5 % bis 2,5 %).23,24
BIC/FTC/TAF wird einmal täglich durch den Mund mit oder ohne Nahrung verabreicht. Die am häufigsten gemeldeten unerwünschten Wirkungen bei Patienten waren Durchfall, Übelkeit und Kopfschmerzen.20-24
Dolutegravir/Lamivudin (Dovato)
Dolutegravir/Lamivudin (DTG/3TC), ein INSTI und NRTI, wurde 2019 als Kombination zugelassen. Es ist das erste Zwei-Wirkstoff-Komplettregime mit fester Dosierung für die Behandlung von HIV-1-Infektionen bei therapienaiven erwachsenen Patienten. Dies steht im Gegensatz zu den traditionell vorgeschriebenen Standardbehandlungsoptionen mit drei Wirkstoffen. Dies könnte eine Chance für Patienten sein, die aufgrund von unerwünschten Wirkungen oder unvermeidlichen Wechselwirkungen mit anderen Medikamenten keines der üblichen Drei-Wirkstoff-Schemata vertragen.25,26
Die Wirksamkeit und Sicherheit der Kombination Dolutegravir/Lamivudin wurde in zwei identischen Studien, GEMINI-1 und GEMINI-2, nachgewiesen.27 An diesen Studien nahmen insgesamt 1.433 HIV-1-infizierte, nicht therapiebedürftige Erwachsene teil, die nach dem Zufallsprinzip entweder eine Zwei-Wirkstoff-Kombination (Dolutegravir 50 mg plus Lamivudin 150 mg) oder eine Drei-Wirkstoff-Kombination (Dolutegravir plus Emtricitabin plus Tenofovir Disoproxilfumarat) erhielten. Beim primären Endpunkt, dem Erreichen einer Viruslast <50 Kopien/ml, erwies sich DTG/3TC als nicht unterlegen – bei 91 % der 716 Patienten, die mit zwei Arzneimitteln behandelt wurden, und bei 93 % der 717 Patienten, die mit drei Arzneimitteln behandelt wurden (Behandlungsdifferenz von -1,7 %; 95 % KI, -4,4 % bis 1,1 %) -, wenn die Ergebnisse der beiden Studien zusammengeführt wurden. Die gepoolten Studien zeigten auch, dass zahlenmäßig weniger Patienten unter dem Zwei-Präparate-Schema als unter dem Drei-Präparate-Schema an arzneimittelbedingten Nebenwirkungen litten (126 von 716 bzw. 169 von 717). Aufgrund der nicht schlechteren Wirksamkeit und eines ähnlichen Verträglichkeitsprofils konnte das Department of Health and Human Services die Kombination DTG/3TC in fester Dosierung in die HIV/AIDS-Leitlinien als empfohlenes Anfangsregime für die meisten HIV-Infizierten aufnehmen.27
Die Kombination Dolutegravir/Lamivudin wird einmal täglich durch den Mund mit oder ohne Nahrung verabreicht. Die häufigsten unerwünschten Wirkungen bei den Patienten sind Kopfschmerzen, Übelkeit, Durchfall, Müdigkeit und Schlaflosigkeit. Obwohl es sich um eine Kombinationstablette mit zwei Medikamenten handelt, muss sie nicht zusammen mit anderen ARV-Medikamenten verabreicht werden, da es sich um ein vollständiges Therapieschema handelt.25-27
Emtricitabin/Tenofovir Alafenamid für die Präexpositionsprophylaxe (PrEP)
Seit 2012 war die einzige von der FDA zugelassene Option für die PrEP FTC/TDF.11 Dies änderte sich 2019 mit der Zulassung der Kombination Emtricitabin/Tenofovir Alafenamid (FTC/TAF),13 einem strukturell ähnlichen Kombinationsmedikament. Es ist nun für den Einsatz in der PrEP bei nicht infizierten Patienten mit hohem Risiko für eine HIV-Übertragung durch Geschlechtsverkehr indiziert. Die Zulassung der PrEP basiert auf der kürzlich durchgeführten DISCOVER-Studie, einer randomisierten Doppelblindstudie, in der FTC/TAF mit dem Standardpräparat FTC/TDF verglichen wurde, um das Risiko einer HIV-1-Infektion bei Männern und Transgender-Frauen zu verringern, die Sex mit Männern haben und einem Risiko für eine HIV-1-Infektion ausgesetzt sind.7 Die Studie wurde als randomisierte, doppelblinde Parallelgruppenstudie mit einer Nachbeobachtungszeit von mindestens 48 Wochen durchgeführt, wobei mindestens 50 % der Teilnehmer eine Nachbeobachtungszeit von 96 Wochen nach der Randomisierung hatten. An der Studie nahmen 5.399 Teilnehmer teil, die im Verhältnis 1:1 in eine der beiden Gruppen randomisiert wurden. Das Hauptziel der Studie war die Bewertung der Inzidenz von HIV-1-Infektionen pro 100 Personenjahre. Unter den 2 694 Teilnehmern in der FTC/TAF-Gruppe wurde bei 7 Patienten eine HIV-1-Infektion festgestellt (0,16/100 Personenjahre). Unter den 2 693 Teilnehmern in der FTC/TDF-Gruppe wurde die HIV-1-Inzidenz bei 15 Patienten (0,34/100 Personenjahre) festgestellt. Diese Inzidenzen zeigen, dass FTC/TAF bei Studienteilnehmern, bei denen ein HIV-Infektionsrisiko bestand, FTC/TDF nicht unterlegen war, und ermöglichten es der FDA schließlich, die Indikationen für FTC/TAF um die PrEP zu erweitern.13
Der Stellenwert von FTC/TAF in der HIV-Therapie ist wahrscheinlich noch unklar. Während es in anderen Bereichen der HIV-Behandlung Verwendung gefunden hat, ist sein Nutzen gegenüber den Alternativen in diesem Bereich noch nicht abschließend geklärt. TAF ist zwar ähnlich, bietet aber möglicherweise eine geringere Inzidenz von Veränderungen der Knochendichte und Nierenfunktionsstörungen – unerwünschte Wirkungen, die mit TDF in Verbindung gebracht werden. Dieser Unterschied ist jedoch nicht eindeutig belegt, und einige Daten deuten darauf hin, dass dieser Vorteil bei Therapien, die keinen pharmakokinetischen Booster wie Cobicistat oder Ritonavir enthalten, möglicherweise klinisch nicht signifikant ist. 27-29
Schlussfolgerung
Aufgrund der Komplexität von HIV und seines Resistenzpotenzials kann die ARV-Therapie für Patienten schnell zur Belastung werden. Zwischen 2018 und heute hat die medizinische Fachwelt eine breite Ausweitung der von der FDA zugelassenen ARV-Therapien für die Behandlung von HIV erlebt. Zu diesen Therapien gehören neue Kombinationstabletten mit fester Dosierung, neue Medikamente, die durch andere Mechanismen wirken als die bisher auf dem Markt befindlichen, und sogar neue Indikationen für bereits vorhandene Medikamente. Diese neuen Medikamente haben sich bereits auf die aktuellen Behandlungsrichtlinien ausgewirkt und können den Patienten zu einem längeren und gesünderen Leben verhelfen.
Der Inhalt dieses Artikels dient nur zu Informationszwecken. Der Inhalt ist nicht als Ersatz für eine professionelle Beratung gedacht. Die Verwendung der in diesem Artikel enthaltenen Informationen erfolgt ausschließlich auf eigenes Risiko.
1. Vella S, Schwartländer B, Sow SP, et al. Die Geschichte der antiretroviralen Therapie und ihrer Umsetzung in ressourcenbeschränkten Gebieten der Welt. AIDS. 2012;26(10):1231-1241.
2. Arts EJ, Hazuda DJ. HIV-1 antiretroviral drug therapy. Cold Spring Harb Perspect Med. 2012;2(4):a007161.
3. Chaudhuri S, Symons JA, Deval J. Innovation and trends in the development and approval of antiviral medicines: 1987-2017 and beyond. Antiviral Res. 2018;155:76-88.
4. Trogarzo (Ibalizumab-uiyk) package insert. Montreal, Quebec: Theratechnologies Inc; März 2018.
5. Pifeltro (Doravirin) package insert. Whitehouse Station, NJ: Merck & Co, Inc; März 2019.
6. Rukobia (Fostemsavir) package insert. Research Triangle Park, NC: GlaxoSmithKline; Juli 2020.
7. Pan F, Chernew ME, Fendrick AM. Impact of fixed-dose combination drugs on adherence to prescription medications. J Gen Intern Med. 2008;23(5):611-614.
8. Verma AA, Khuu W, Tadrous M,et al. Fixed-dose combination antihypertensive medications, adherence, and clinical outcomes: a population-based retrospective cohort study. PLoS Med. 2018;15(6):e1002584.
9. National Institutes of Health. HIVinfo. FDA-zugelassene HIV-Medikamente. hivinfo.nih.gov/understanding-hiv/fact-sheets/fda-approved-hiv-medicines. Accessed September 22, 2020.
10. Prezista (Darunavir) package insert. Titusville, NJ: Janssen Therapeutics; Mai 2019.
11. Truvada (Emtricitabin/Tenofovir Disoproxilfumarat) Packungsbeilage. Foster City, CA: Gilead Sciences, Inc; Juni 2004/2020.
12. Delstrigo (Doravirin/Lamivudin/Tenofovir Disproxil Fumerat) Packungsbeilage. White House Starion, NJ: Merck & Co, Inc; August 2018.
13. Descovy (Emtricitabin/Tenofovir Alafenamid) Packungsbeilage. Foster City, CA: Gilead Sciences, Inc; Dezember 2019.
14. Tivicay (dolutegravir) package insert. Research Triangle Park, NC. GlaxoSmithKline; Juni 2020.
15. Iacob SA, Iacob DG. Ibalizumab, das auf CD4-Rezeptoren abzielt, ein neues Molekül in der HIV-Therapie. Front Microbiol. 2017;8:2323.
16. Emu B, Fessel J, Schrader S, et al. Phase-3-Studie von Ibalizumab für multiresistente HIV-1. N Engl J Med. 2018;379:645-654.
17. Li Z, Zhou N, Sun Y, et al. Activity of the HIV-1 attachment inhibitor BMS-626529, the active component of the prodrug BMS-663068, against CD4-independent viruses and HIV-1 envelopes resistant to other entry inhibitors. Antimicrob Agents Chemother. 2013:57(9):4172-4180.
18. Kozal M, Aberg J, Pialoux G. Fostemsavir bei Erwachsenen mit multiresistenter HIV-1-Infektion. N Engl J Med. 2020;382(13):1232-1243.
19. Cahn P, Fink V, Patterson P. Fostemsavir: a new CD4 attachment inhibitor. Curr Opin HIV AIDS. 2018;13(4):341-345.
20. Biktarvy (bictecgravir/emtricitabine/tenofovir alafenamide) package insert. Foster City, CA: Gilead Sceinces, Inc; Februar 2018.
21. Gallant J, Lazzarin A, Mills M, et al. Bictegravir, Emtricitabin und Tenofovirafenamid im Vergleich zu Dolutegravir, Abacavir und Lamivudin zur Erstbehandlung der HIV-1-Infektion (GS-US-380-1489): eine doppelblinde, multizentrische, randomisierte, kontrollierte Nicht-Unterlegenheitsstudie der Phase 3. Lancet. 2017;390(10107):2063-2072.
22. Sax PE, Pozniak A, Montes M, et al. Coformulated bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir with emtricitabine and tenofovir alafenamide, for initial treatment of HIV-1 infection (GS-US-380-1490): a randomised, double-blind, multicentre, phase 3, non-inferiority trial. Lancet. 2017;390(10107):2073-2082.
23. Malina JM, Ward D, Brar I, et al. Switching to fixed-dose bictegravir, emtricitabine, and tenofovir alafenamide from dolutegravir plus abacavir andlamivudine in virologically suppressed adults with HIV-1: 48 week results of a randomised, double-blind, multicentre, active-controlled, phase 3, non-inferiority trial. Lancet HIV. 2018;5(7):E357-E365.
24. Daar ES, De Jesus E, Ruane P, et al. Efficacy and safety of switching to fixed-dose bictegravir, emtricitabine, and tenofovir alafenamide from boosted protease inhibitor-based regimens in virologically suppressed adults with HIV-1: 48-week results of a randomized, open-label, multicentre, phase 3, non-inferiority trial. Lancet HIV. 2018;5(7):e347-e356.
25. Dovato (Dolutegravir/Lamivudin) package insert. Research Triangle Park, NC: GlaxoSmithKline. March 2020.
26. Scott LJ. Dolutegravir/Lamivudin als Einzeltablettenregime: eine Überprüfung bei HIV-1-Infektion. Drugs. 2020;80(1):61-72.
27. Cahn P, Madero JS, Arribas JR, et al. GEMINI Study Team. Dolutegravir plus Lamivudin versus Dolutegravir plus Tenofovir Disoproxilfumarat und Emtricitabin bei antiretroviral-naiven Erwachsenen mit HIV-1-Infektion (GEMINI-1 und GEMINI-2): Ergebnisse der Woche 48 aus zwei multizentrischen, doppelblinden, randomisierten, nicht unterlegenen Phase-3-Studien. Lancet. 2019;393(10167):143-155.
28. Mayer KH, Molina JM, Thompson MA, et al. Emtricitabine and tenofovir alafenamide vs. Emtricitabine and tenofovir disoproxil fumarate for HIV pre-exposure prophylaxis (DISCOVER): primary results from a randomised, double-blind multicentre, active-controlled, phase 3 non-inferiority trial. Lancet. 2020;396(10246):239-254.
29. Hill A, Hughes SL, Gotham D, Pozniak AL. Tenofovir alafenamide versus Tenofovir disoproxil fumarate: Gibt es einen echten Unterschied in Wirksamkeit und Sicherheit? J Virus Erad. 2018;4(2):72-79.