Les antibiotiques éradiquent les infections pathogènes et sauvent des vies – mais ce faisant, ils perturbent également l’intégrité du microbiome intestinal. Si de nombreux médecins reconnaissent la nécessité de rétablir l’équilibre microbien d’un patient après un traitement antibiotique, beaucoup moins comprennent comment le faire efficacement.
Selon Amie Skilton, ND, la restauration de la flore intestinale est à la fois un art et une science. Bien faite, elle peut faire un monde de différence pour les patients. Dans certains cas, elle peut même aider les patients à surmonter les maladies pour lesquelles les antibiotiques ont été initialement prescrits.
Mais il faut plus que simplement recommander un probiotique du commerce et espérer le meilleur.
Les Centers for Disease Control ont signalé au printemps dernier que sur les 154 millions d’ordonnances d’antibiotiques rédigées dans les cabinets médicaux et les services d’urgence chaque année, 30 % sont inutiles. La plupart des ordonnances superflues, selon le CDC, ont été délivrées pour des affections respiratoires causées par des virus comme le rhume, les angines virales, la bronchite et les infections des sinus et des oreilles, qui ne répondent pas aux antibiotiques. L’utilisation de ces médicaments « exposait les patients à des risques inutiles de réactions allergiques ou de diarrhée parfois mortelle, le Clostridium difficile. »
Pour compliquer encore le tableau, il faut savoir que les antibiotiques ne sont pas seulement dispersés depuis les cabinets médicaux ; ils sont aussi donnés généreusement au bétail et pulvérisés abondamment sur les produits, laissant des traces infimes mais biologiquement actives dans les aliments que les humains consomment ensuite.
La dose, le moment déterminent l’impact
Lorsque les antibiotiques tuent les micro-organismes responsables des infections, ils détruisent aussi de manière non sélective les communautés de bactéries intestinales bénéfiques, affaiblissant la stabilité du microbiome intestinal. Cette destruction globale peut être massive ; les données expérimentales recueillies dans le cadre d’une étude utilisant la qPCR indiquent une réduction jusqu’à 10 fois des isolats bactériens immédiatement après un traitement aux antibiotiques (Panda, S. et al. PLoS One. 2014 ; 9(4) : e95476).
« C’est vraiment un effet décimant », déclare le Dr Skilton, médecin naturopathe et herboriste à l’Elysium Clinic of Natural Medicine, Sydney, NSW, Australie.
Dans un webinaire parrainé par Holistic Primary Care and Bioceuticals, elle a exposé la myriade d’impacts des antibiotiques sur le microbiome humain, notant que tous les antibiotiques ne sont pas également destructeurs pour les bactéries intestinales.
Le degré auquel ces médicaments endommagent le microbiote intestinal dépend du type de médicament, de la durée du traitement et de la fréquence d’utilisation, a expliqué Mme Skilton. Certains antibiotiques, par exemple, déclenchent une plus grande libération d’endotoxines et de cytokines que d’autres. Des doses quotidiennes plus élevées ont plus d’impact. L’utilisation prolongée d’antibiotiques à fortes doses peut causer des dommages extrêmes au microbiome qui peuvent prendre des années de thérapie réparatrice pour être inversés, si tant est qu’ils puissent l’être.
Et contrairement à la croyance commune, les antibiotiques intraveineux peuvent avoir le même impact négatif sur la flore intestinale que les médicaments oraux. « Pendant longtemps, on a pensé que les médicaments par voie intraveineuse contournaient l’intestin et n’avaient pas le même impact. Nous savons maintenant que ce n’est pas vrai. »
Le moment de l’administration de l’antibiotique fait également une différence. Les personnes qui utilisent fréquemment des antibiotiques au début de leur vie sont plus vulnérables à de nombreux types de maladies lorsqu’elles vieillissent. Dans un article publié plus tôt cette année, les chercheurs ont démontré une association entre l’utilisation d’antibiotiques pendant la petite enfance et de mauvais résultats neurocognitifs ultérieurs, suggérant que la consommation d’antibiotiques pendant la première année de vie d’un patient était associée à des différences faibles mais statistiquement significatives dans les mesures cognitives, comportementales et de l’humeur pendant l’enfance (Slykerman, R. et al. Acta Paediatr. 2017 ; 106(1) : 87-94).
D’autres ont établi un lien entre l’exposition aux antibiotiques du fœtus et de la petite enfance et le développement ultérieur de l’asthme plus tard dans la vie (Örtqvist, A. et al. Brit Med J. 2014 ; 349. doi : https://doi.org/10.1136/bmj.g6979). Les antibiotiques ont également été associés à l’obésité et à la prise de poids chez les enfants comme chez les adultes (Million, M. et al. Clin Microbiol & Infec. 2013 ; 19(4) : 305-313). Les chercheurs attribuent ces changements à l’altération de la composition microbienne intestinale.
Les antibiotiques peuvent déclencher la libération de lipopolysaccharides (LPS) toxiques, de grosses molécules présentes dans les membranes externes des bactéries Gram-négatives pathogènes. Certains suggèrent que la libération de LPS induite par les antibiotiques peut contribuer au développement d’un choc septique chez les patients traités pour des infections graves causées par des bactéries Gram-négatives. D’autres ont démontré que le LPS déclenche une réponse immunitaire en libérant des cytokines inflammatoires, un problème qui s’aggrave après un traitement antibiotique, a noté Skilton dans son webinaire (Wu, T. et al. Toxicol Lett. 2009 ; 191(2-3) : 195-202).
Du point de vue de l’agent pathogène, la production de LPS est une stratégie de survie. Ces molécules interagissent sur les surfaces cellulaires pour former une barrière, empêchant les antibiotiques et autres composés hydrophobes de pénétrer et permettant aux bactéries Gram-négatives de vivre même dans des environnements difficiles (Zhang, G. et al. Curr Opin Microbiol. 2013 ; 16(6) : 779-785).
Comment restaurer la flore
Les probiotiques sont un aspect d’une stratégie globale visant à restaurer la flore intestinale après une antibiothérapie. Compte tenu de la diversité microbienne d’un écosystème intestinal sain, Skilton recommande d’utiliser des produits qui contiennent de nombreuses espèces différentes de microbes bénéfiques plutôt que de faire de la « monoculture » avec une ou deux souches uniques.
En règle générale, elle conseille un mois de traitement probiotique pour chaque semaine où un patient était sous antibiotiques. Ceux qui ont suivi un régime antibiotique continu et prolongé, auront également besoin d’une restauration à long terme. Elle a souligné que pour la plupart des gens, il n’y a pas de risques pour la santé associés à une supplémentation prolongée en probiotiques.
Les patients recevant des antibiotiques par voie IV devraient également prendre des probiotiques commensaux. Certains cliniciens conscients de cette question commenceront les probiotiques dès quatre heures après une dose d’antibiotiques IV.
Reconstruction du glycocalyx
Les personnes qui ont reçu des traitements antibiotiques à long terme ou multiples présentent généralement une érosion sévère du glycocalyx qui recouvre normalement les microvillosités intestinales. Cela s’accompagne généralement d’une perte des bords en brosse et d’une réduction marquée de la production d’IgA sécrétoire.
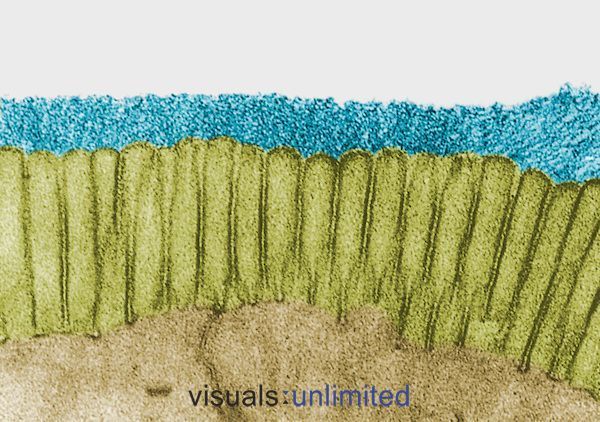 Dans certains cas, ces changements sont causés par les effets des antibiotiques eux-mêmes. Dans d’autres, ils reflètent l’impact de l’infection pour laquelle les antibiotiques ont été prescrits. Quoi qu’il en soit, l’effet est le même : établissement d’un microenvironnement hospitalier pour les pathogènes opportunistes comme Candida, mais de plus en plus difficile pour les bactéries commensales normales.
Dans certains cas, ces changements sont causés par les effets des antibiotiques eux-mêmes. Dans d’autres, ils reflètent l’impact de l’infection pour laquelle les antibiotiques ont été prescrits. Quoi qu’il en soit, l’effet est le même : établissement d’un microenvironnement hospitalier pour les pathogènes opportunistes comme Candida, mais de plus en plus difficile pour les bactéries commensales normales.
Les infections fongiques sont presque toujours accompagnées d’une production insuffisante d’IgA, car Candida consomme à la fois le glycocalyx et la sIgA comme combustibles. Cela devient un cercle vicieux : une faible IgA engendre le Candida qui épuise encore plus les IgA. Les infections chroniques des voies urinaires, et les infections des muqueuses comme le muguet sont des signaux d’alarme pour une faible production de sIgA, a souligné Skilton.
Sans un glycocalyx sain, les organismes comme les Lactobacilles et les Bifidobacilles ont beaucoup de mal à s’établir. Dans ce contexte, la supplémentation avec des probiotiques ordinaires échoue généralement.
« Même si vous recommandez les meilleurs probiotiques du monde, ils n’ont aucun moyen de s’accrocher et de coloniser si le glycocalyx est érodé », a expliqué le Dr Skilton. « Vous pouvez en fait exagérer les symptômes gastro-intestinaux en donnant des probiotiques, s’il y a perte de la capacité à produire le glycocalyx. »
Pour rétablir un microenvironnement plus sain dans ces cas, vous devez tirer parti des caractéristiques uniques de Saccharomyces boulardii, une levure probiotique résistante aux antibiotiques, isolée à l’origine des fruits du litchi en Indochine. Bien que n’étant pas un véritable organisme commensal, S. boulardii est un puissant inducteur de la production de glycocalyx et de la sécrétion d’IgA. Il stimule également les enzymes de la bordure en brosse et favorise la production de polyamines, ce qui nourrit les microvillosités intestinales et peut être utile pour guérir la colite ulcéreuse, la maladie de Crohn et le syndrome du côlon irritable.
S. boulardii est capable d’agir dans le contexte de bactéries résistantes aux antibiotiques hautement pathogènes comme Clostridium difficile et a effectivement été utilisé comme thérapie préventive contre la diarrhée associée à C. difficile (Goldstein, E. et al. Clin Infect Dis. 2015 ; 60 (suppl_2) : S148-S158). S. boulardii peut réduire certains des effets toxiques de l’entérotoxine A en inhibant la liaison des récepteurs de la toxine A et en empêchant la formation de l’entérotoxine B.
Mais le plus remarquable est sa capacité à coloniser rapidement l’endothélium endommagé et à déplacer les levures pathogènes tout en créant simutanément un microenvironnement plus sain pour les bactéries commensales. « S. boulardii force en fait l’évacuation physique du Candida », a déclaré le Dr Skilton en précisant qu’il est spécifiquement actif contre 7 des 8 espèces de Candida pathogènes les plus courantes. La seule exception est C. tropicalis.
« Pensez à la situation comme les conséquences d’un ouragan qui frappe un village. Les antibiotiques sont l’ouragan. Le S. boulardii est comme l’entrepreneur qui vient réparer les dommages causés au village. Vous pouvez ensuite repeupler le village avec des commensaux. »
BioCeuticals, une société australienne de nutraceutiques réservée aux praticiens, a récemment lancé un produit appelé SB Floractiv, fournissant 250 mg de S. boulardii (également appelé S. cereviciae) par capsule.
Pour les patients qui ont été sous antibiotiques à long terme, commencez lentement avec une capsule (250 mg) par jour pendant 3-4 jours, puis augmentez à deux par jour pendant encore 3-4 jours, puis augmentez selon un schéma similaire par étapes jusqu’à quatre par jour (1000 mg) qui devraient être poursuivis pour le reste d’une période de 4 semaines.
S. boulardii est très sûr, et la seule véritable contre-indication est chez les patients présentant de véritables réactions aux levures médiées par les IgE, se manifestant par une anaphylaxie ou  une urticaire. Cela dit, il est important de savoir que dans les premiers jours de la prise de S. boulardii, certains patients peuvent ressentir un « nettoyage intestinal » notable, car la levure probiotique déplace les espèces de Candida. La disparition des Candida peut également rendre les gens malades. Il est préférable d’informer les patients de ces possibilités à l’avance, afin qu’ils ne soient pas surpris si elles se produisent.
une urticaire. Cela dit, il est important de savoir que dans les premiers jours de la prise de S. boulardii, certains patients peuvent ressentir un « nettoyage intestinal » notable, car la levure probiotique déplace les espèces de Candida. La disparition des Candida peut également rendre les gens malades. Il est préférable d’informer les patients de ces possibilités à l’avance, afin qu’ils ne soient pas surpris si elles se produisent.
Selon le Dr Skelton, chez 9 patients sur 10, quatre semaines de supplémentation intensive en S. boulardii sont siffuantes pour restaurer une couche glycocalyx saine et induire une sécrétion adéquate d’IgA. Cela prépare ensuite le terrain pour un cycle de restauration beaucoup plus efficace avec un probiotique multi-souches.
Bioceuticals a conçu un produit spécifiquement destiné à être utilisé après les antibiotiques. Appelé BioFloractiv 500, il contient 500 milliards d’UFC, 12 espèces et 14 souches de bactéries bénéfiques. Le Dr Skilton recommande un maximum de 14 jours, bien qu’une semaine de traitement quotidien soit suffisante pour la plupart, selon Skilton.
Les patients atteints du syndrome du côlon irritable ou de la maladie de Crohn, cependant, peuvent avoir besoin d’un soutien à plus long terme pour reconstruire un microbiome sain après avoir pris des antibiotiques.
Une approche globale
Les probiotiques ne sont qu’une partie du tableau. Et si un patient ne peut tolérer aucun type de probiotique, c’est un drapeau rouge qui indique que le système immunitaire du patient ne fonctionne pas correctement.
« Vous devez d’abord traiter tous les aspects du système nerveux, en particulier la dominance sympathique, qui peuvent affecter le tube digestif », a déclaré le Dr Skilton. Elle a constaté que l’huile de poisson, le zinc, la vitamine A et le colostrum sont utiles dans de nombreux cas. Ce dernier « est vraiment bon pour rétablir l’immunoglobuline spécifique. Faites-le pendant une semaine environ avant d’essayer les probiotiques ». L’orme rouge et les suppléments de glutamine peuvent également être utiles dans certains cas.
Les médicaments à base de plantes comme l’huile d’origan, l’huile d’arbre à thé ou l’extrait de pau d’arco peuvent être utiles pour débarrasser le tube digestif des levures pathogènes. Mais le Dr Skilton insiste sur le fait qu’ils ne stimulent en rien la production d’IgA, et que les infections chroniques à levures sont presque toujours associées à un faible taux d’IgA. Ces chasseurs de levures naturels ne doivent jamais être utilisés en même temps que S. boulardii ; cette levure « amicale » est tout aussi vulnérable à des choses comme l’origan et l’arbre à thé que les levures pathogènes.
Un certain nombre d’aliments probiotiques et prébiotiques peuvent aider le processus de restauration de l’intestin. Tom O’Bryan, DC, fondateur du Gluten Summit et du programme de formation Certified Gluten Practitioner, recommande plusieurs aliments à consommer – et plusieurs à éviter – lors de la reconstruction de l’intestin après un traitement antibiotique.
« Lorsque votre intestin a été compromis, vous ne voulez pas taxer votre intestin », dit O’Bryan. Les aliments « taxants » comprennent le blé, les produits laitiers, le sucre, les graisses malsaines et les articles frits. Ces aliments, note-t-il, « jettent de l’essence sur le feu » d’un système intestinal en voie de rétablissement.
En revanche, il faut manger beaucoup d’aliments qui favorisent la croissance d’organismes commensaux sains. O’Bryan recommande les pommes biologiques en compote, cuites jusqu’à ce qu’elles soient tendres et chatoyantes, comme une bonne option. La cuisson des pommes, explique-t-il, libère de la pectine – une fibre soluble qui fournit du carburant aux bactéries bénéfiques.
La pectine présente dans les pommes en compote peut également aider à guérir une paroi intestinale endommagée et à sceller les déchirures dans un intestin qui fuit, empêchant les grosses molécules alimentaires de passer.
De même, le collagène aide à sceller un intestin qui fuit. O’Bryan encourage également les patients qui se remettent d’un traitement antibiotique à manger du bouillon d’os de poulet, une bonne source de collagène, qui agit également comme un prébiotique naturel, nourrissant les bactéries saines dans l’intestin.
Le butyrate – une substance naturelle fabriquée dans l’intestin – est un autre acteur important dans la restauration des bactéries intestinales. O’Bryan explique que les cellules qui tapissent l’intérieur de l’intestin se reproduisent rapidement et que le butyrate alimente la reconstruction de nouvelles cellules. Une production insuffisante de butyrate et un renouvellement lent des cellules intestinales rendent l’organisme plus vulnérable au développement de cellules cancéreuses, d’où un risque plus élevé de cancer du côlon.
Un éventail de fruits et légumes prébiotiques, y compris les aliments bananes, patates douces et autres tubercules aident à reconstruire le microbiome intestinal, en fournissant des fibres insolubles qui nourrissent les bonnes bactéries – mais pas les bactéries nocives.
Les légumes fermentés et non pasteurisés comme la choucroute, le kimchi et les betteraves fermentées, sont une autre excellente source de probiotiques naturels. Chaque légume produit différentes familles de bactéries bénéfiques pendant la fermentation, note O’Bryan, qui encourage les patients à manger une fourchette de légumes fermentés deux fois par jour. « La clé de la santé de votre intestin est la diversité de votre microbiome », fait-il valoir, soulignant que des milliers de familles de bactéries différentes vivent et interagissent dans l’intestin avec des impacts très variés sur notre santé.
END