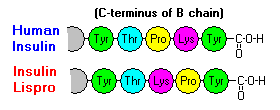Patofisiologia del vivo
Struttura dell’insulina
L’insulina è composta da due catene peptidiche denominate catena A e catena B. Le catene A e B sono legate tra loro da due legami disolfuro, e un ulteriore disolfuro si forma all’interno della catena A. Nella maggior parte delle specie, la catena A consiste di 21 aminoacidi e la catena B di 30 aminoacidi.
Anche se la sequenza aminoacidica dell’insulina varia tra le specie, alcuni segmenti della molecola sono altamente conservati, comprese le posizioni dei tre legami disolfuro, entrambe le estremità della catena A e i residui C-terminali della catena B. Queste somiglianze nella sequenza aminoacidica dell’insulina portano ad una conformazione tridimensionale dell’insulina che è molto simile tra le specie, e l’insulina di un animale è molto probabilmente biologicamente attiva in altre specie. Infatti, l’insulina di maiale è stata ampiamente utilizzata per trattare i pazienti umani.
Le molecole di insulina hanno la tendenza a formare dimeri in soluzione a causa del legame a idrogeno tra i terminali C delle catene B. Inoltre, in presenza di ioni di zinco, i dimeri di insulina si associano in esameri.
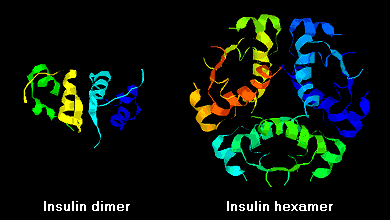
Queste interazioni hanno importanti ramificazioni cliniche. I monomeri e i dimeri si diffondono facilmente nel sangue, mentre gli esameri si diffondono poco. Quindi, l’assorbimento delle preparazioni di insulina contenenti un’alta proporzione di esameri è ritardato e un po’ lento. Questo fenomeno, tra gli altri, ha stimolato lo sviluppo di un certo numero di analoghi dell’insulina ricombinante. La prima di queste molecole ad essere commercializzata – chiamata insulina lispro – è ingegnerizzata in modo tale che i residui di lisina e prolina sull’estremità C-terminale della catena B sono invertiti; questa modifica non altera il legame del recettore, ma minimizza la tendenza a formare dimeri ed esami.