Chemicy doceniają izotopy i używają ich w badaniach podstawowych i stosowanych. Jednakże, są one bardziej zainteresowane z ruchem elektronów. Kiedy atom zyskuje lub traci elektrony, staje się naładowanym gatunkiem lub jonem. W takim przypadku jądro nie ulega zmianie. W przypadku atomów, które tracą elektrony, powstaje ogólny ładunek dodatni (#protony > #elektrony). Atomy, które tworzą tego typu jony nazywane są kationami. Atomy metali (znajdujące się po lewej stronie układu okresowego) zawsze tracą elektrony, aby stać się kationami.
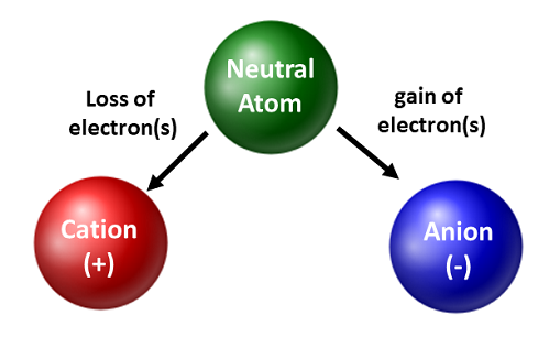
W przeciwieństwie do atomów metali, niemetale zyskują elektrony, aby stać się anionami. Tego typu jony mają ogólny ładunek ujemny (#elektrony > #protony). Z wyjątkiem gazów szlachetnych, wszystkie atomy w układzie okresowym będą tracić lub zyskiwać elektrony, aby osiągnąć stabilność elektroniczną. Różne rodzaje wiązań występują, gdy atomy tracą, zyskują lub dzielą się elektronami. Te typy połączeń atomowych będą dalej omawiane w rozdziale 4 twojego podręcznika.
Interaktywne: Budowanie Atomu
Zbuduj atom z protonów, neutronów i elektronów, i zobacz jak zmienia się element, ładunek i masa. Następnie zagraj w grę, aby sprawdzić swoje pomysły!
W tym momencie powinieneś być w stanie obliczyć wszystkie cząstki subatomowe, gdy podany jest określony ładunek jonu. Ponadto powinieneś opanować klasyfikacje jonów (rozpoznanie, że kationy są dodatnie, a aniony ujemne). Zapamiętanie ładunków konkretnych jonów będzie wymagane przy pracy nad rozdziałem 4 podręcznika. Na razie ładunki jonów będą podane i nie należy ich zapamiętywać. Zauważ i doceń ładunki jonów pierwiastków grupy głównej w poniższym układzie okresowym. Na koniec, chemicy nie piszą liczby dla ładunków zawierających liczbę jeden (1). Dla tych gatunków, zobaczysz tylko znak + lub -. Ładunki o większej wielkości zawsze będą miały liczbę związaną z symbolem pierwiastka.
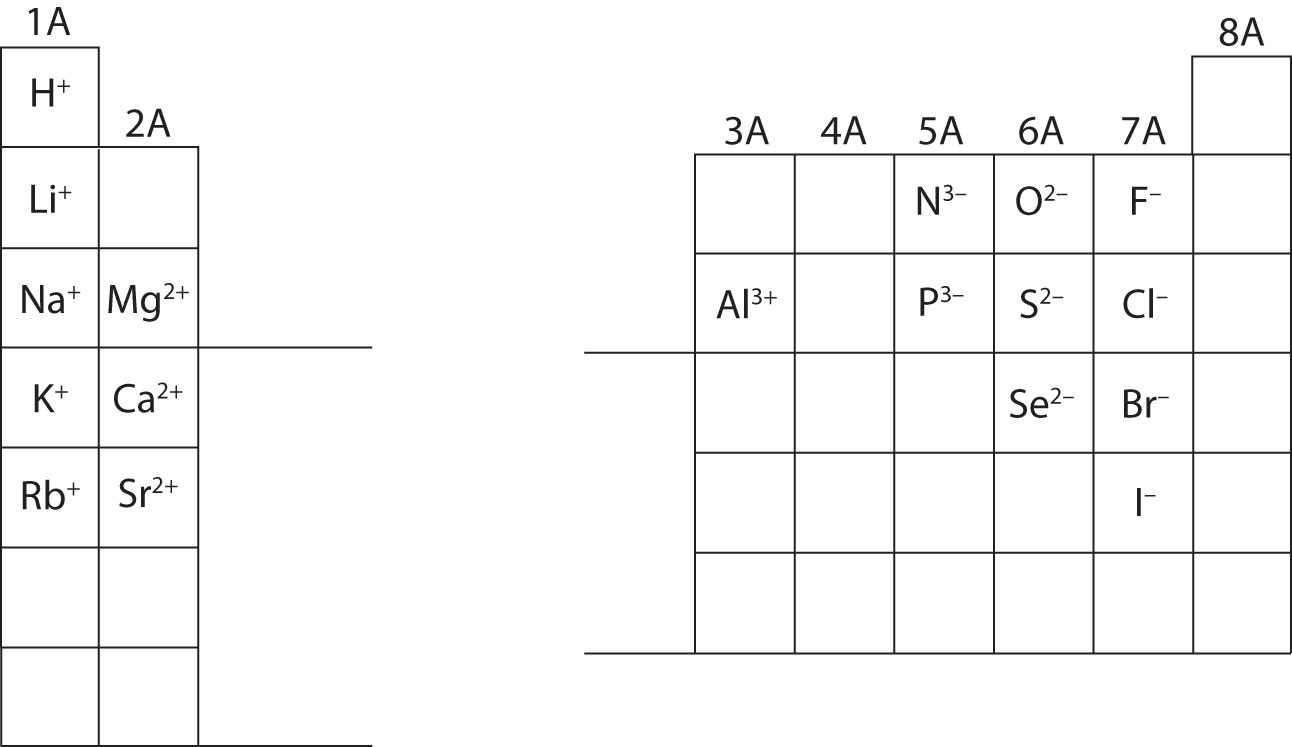
Przykład: IOnic Classification
Oblicz cząstki subatomowe dla poniższych gatunków, korzystając z informacji zawartych na rysunku \(\PageIndex{2}}). Oznacz każdą z nich jako atom, kation lub anion. Odwołaj się do układu okresowego dla mas, liczb atomowych i specyficznych ładunków jonów.
- Jon glinu
- Atom cyrkonu
- Jon siarki
Rozwiązania
- W jonie glinu znajduje się 13 protonów, 14 neutronów i 10 elektronów. Ten jon jest dodatnio naładowany, co oznacza, że stracił elektrony i tworzy kation.
- W atomie cyrkonu znajduje się 40 protonów, 51 neutronów i 40 elektronów. Jest to atom, który nie ma ładunku całkowitego.
- Jest 16 protonów, 16 neutronów i 18 elektronów w jonie siarki. Jon ten jest naładowany ujemnie, co oznacza, że zyskał elektrony i tworzy anion.
Przykład: Zapis mas A/Z i symbolu
Pisz zapisy mas A/Z i symbolu dla jonów/atomów z poprzedniego pytania.
Rozwiązania
- (^^{27}_{13}Al^{3+}}) i Al-27
- (^{91}_{40}Zr}}) i Zr-.91
- (^{32}_{16}S}^{2-}}) i S-32
Jeśli atom zyskuje lub traci elektrony, powinno to być przedstawione w formacie A/Z. Format symbol-masa nie wyświetla ładunku jonu. Pamiętaj, neutrony i protony nie są dotknięte przez zmiany elektronów.
Need More Practice?
- Turn to Section 3.E niniejszego OER i rozwiąż problemy #5 i #9.
Wydawcy
-
Elizabeth R. Gordon (Furman University)
.