Vejamos agora o quadro completo. Há uma escala para ácidos e bases, como tudo o resto. Aqui estão algumas definições que você deve saber:
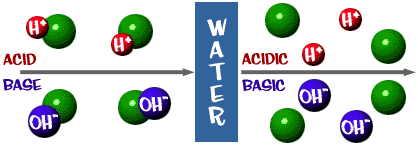
Acid: Uma solução que tem um excesso de iões H+. Vem da palavra latina acidus, que significa “agudo” ou “azedo”.
Base: Uma solução que tem um excesso de iões OH. Outra palavra para base é álcali.
Aquoso: Uma solução que é principalmente água. Pense na palavra aquário. AQUA significa água.
Ácido forte: Um ácido que tem um pH muito baixo (0-4).
Base forte: Uma base que tem um pH muito alto (10-14).
Ácido fraco: Um ácido que só ioniza parcialmente numa solução aquosa. Isto significa que nem todas as moléculas se partem. Ácidos fracos normalmente têm um pH próximo de 7 (3-6).
Base Fraca: Uma base que só se ioniza parcialmente numa solução aquosa. Isto significa que nem todas as moléculas se partem. As bases fracas geralmente têm um pH próximo de 7 (8-10).
Neutro: Uma solução que tem um pH de 7. Não é ácida nem básica.
Contactamos-lhe aquele tipo Arrhenius e as suas ideias sobre concentrações de hidrogénio e iões hidróxidos. Você também vai aprender sobre as idéias de Brønsted-Lowry. Estes dois químicos da Dinamarca e Inglaterra olharam para os ácidos como doadores e as bases como aceitadores. O que é que eles estavam a doar e a aceitar? Íons de hidrogênio. É muito parecido com a primeira definição que demos, onde um ácido se rompe e libera/dona um íon de hidrogênio. Esta definição mais recente é um pouco mais detalhada. Os cientistas usaram a nova definição para descrever mais bases, como o amoníaco (NH3). Como as bases são aceitadoras de prótons, quando a amônia foi vista aceitando um H+ e criando um íon de amônia (NH4+), ela poderia ser rotulada como uma base. Você não precisava mais se preocupar com íons hidróxidos. Se ele recebia o H+ de uma molécula de água, então a água (H2O) era o doador de prótons. Isso significa que a água era o ácido nesta situação? Sim.
Um químico chamado Lewis ofereceu uma terceira maneira de olhar para os ácidos e bases. Em vez de olhar para os iões de hidrogénio, ele olhou para os pares de electrões (lembra-se das nossas fotografias com estruturas de pontos em Átomos e Elementos?). Na opinião de Lewis, ácidos aceitam pares de elétrons e bases doam pares de elétrons. Sabemos que ambas estas descrições de ácidos e bases usam termos completamente opostos, mas a ideia é a mesma. Os íons hidrogênio ainda querem aceitar dois elétrons para formar uma ligação. As bases querem desistir deles. Em geral, a definição de Lewis foi capaz de classificar ainda mais compostos como ácidos ou bases.
O que realmente acontece?
O que realmente acontece nessas soluções? Isto aqui fica um pouco complicado. Vamos ver a quebra de moléculas em soluções aquosas (à base de água) mais uma vez para uma boa medida. Os ácidos são compostos que se dissociam (quebram) em iões de hidrogénio (H+) e outro composto quando colocados numa solução aquosa. Lembra-se do exemplo do ácido acético? Bases são compostos que se decompõem em íons hidróxidos (OH-) e outro composto quando colocados em uma solução aquosa. Vamos falar sobre bicarbonato de sódio em alguns parágrafos.
Vamos mudar um pouco a formulação. Se você tiver um composto iônico/eletrovalente e o colocar em água, ele se separará em dois íons. Se um desses íons for H+, a solução é ácida. O cloreto de hidrogénio ácido forte (HCl) é um exemplo. Se um dos iões for OH-, a solução é básica. Um exemplo de uma base forte é o hidróxido de sódio (NaOH). Existem outros íons que fazem soluções ácidas e básicas, mas não vamos falar sobre eles aqui.
Que a escala de pH de que falamos é na verdade uma medida do número de íons H+ em uma solução. Se há muitos íons H+, o pH é muito baixo. Se há muitos íons OH- em comparação com o número de íons H+, o pH é alto.
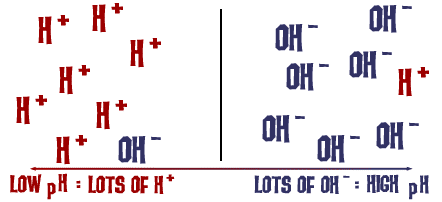
Pense um segundo sobre esta ideia: Porque é que um líquido com níveis elevados de NaOH seria muito básico, mas perigoso ao mesmo tempo? A ligação de NaOH quebra em solução e você tem íons sódio (positivo) e íons hidróxidos (negativo). Os íons sódio não representam realmente um perigo em solução, mas há um grande número de íons hidróxidos em solução em comparação com os íons hidrogênio que podem estar flutuando como H3O+ (um íon hidrônio). A mesma coisa acontece numa escala menos perigosa quando se adiciona bicarbonato de sódio à água. Durante a dissociação, os íons OH- e o ácido carbônico são liberados na solução. O número de íons OH- é maior que o número de íons H3O+ (H+ e H2O), e o pH aumenta. Não é uma diferença tão forte como no hidróxido de sódio.
É basicamente isso. (Ha ha! Percebeste?)
Mais informação na parte um.
Vídeo relacionado…
Encyclopædia Britannica: Bases
Wikipedia: Ácidos
Wikipédia: Bases
A Enciclopédia.com: Ácidos
Aciclopédia.com: Bases