Cimiștii apreciază izotopii și îi folosesc în cercetarea fundamentală și aplicată. Cu toate acestea, ei sunt mai preocupați de mișcarea electronilor. Atunci când un atom câștigă sau pierde electroni, acesta devine o specie încărcată sau un ion. Când se întâmplă acest lucru, nucleul nu este modificat. În cazul atomilor care pierd electroni, va rezulta o sarcină globală pozitivă (#protoni > #electroni). Atomii care formează aceste tipuri de ioni se numesc cationi. Atomii metalelor (situați în partea stângă a tabelului periodic) pierd întotdeauna electroni pentru a deveni cationi.
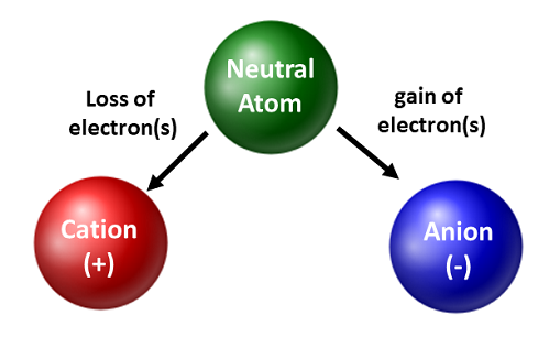
În comparație cu atomii metalici, nemetalii vor câștiga electroni pentru a deveni anioni. Aceste tipuri de ioni au o sarcină globală negativă (#electroni > #protoni). Cu excepția gazelor nobile, toți atomii din tabelul periodic vor pierde sau câștiga electroni pentru a obține stabilitate electronică. Diferite tipuri de legături apar atunci când atomii pierd, câștigă sau împart electroni. Aceste tipuri de legături atomice vor fi discutate mai detaliat în capitolul 4 din manualul dumneavoastră.
Interactiv: Construirea unui atom
Construiți un atom din protoni, neutroni și electroni și vedeți cum se schimbă elementul, sarcina și masa. Apoi jucați un joc pentru a vă testa ideile!
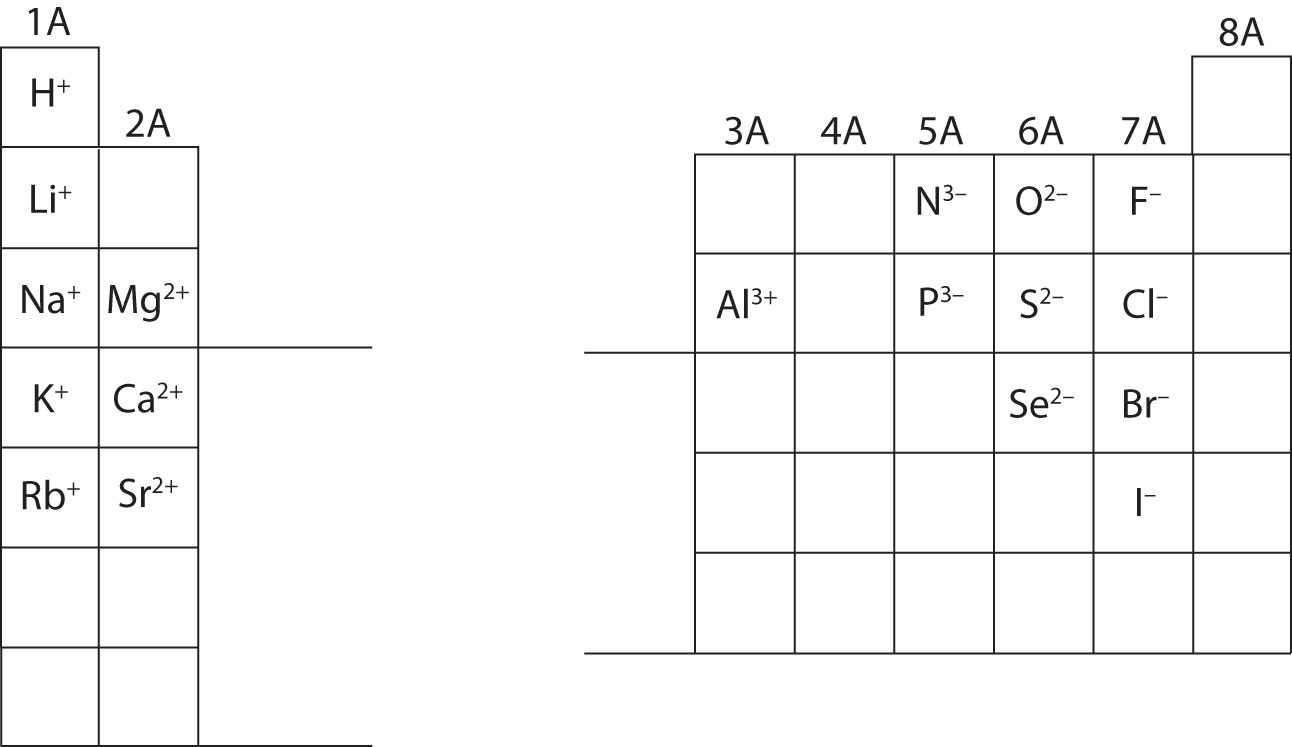
În acest moment, ar trebui să puteți calcula toate particulele subatomice atunci când vi se dă o anumită sarcină ionică. În plus, ar trebui să stăpâniți clasificările ionilor (recunoscând că cationii sunt pozitivi și anionii sunt negativi). Memorarea sarcinilor ionilor specifici va fi necesară atunci când veți lucra la capitolul 4 din manual. Pentru moment, sarcinile ionilor vor fi furnizate și nu trebuie memorate. Rețineți și apreciați sarcinile ionice pentru elementele din grupa principală din tabelul periodic de mai jos. În cele din urmă, chimiștii nu scriu un număr pentru sarcinile care implică cifra unu (1). Pentru aceste specii, veți vedea doar un semn + sau -. Încărcăturile de mărime mai mare vor avea întotdeauna un număr asociat cu simbolul elementar.
Exemplu \(\PageIndex{1}\): Clasificare IOnică
Calculați particulele subatomice pentru speciile de mai jos folosind informațiile din figura \(\PageIndex{2}\). Etichetați fiecare ca fiind un atom, un cation sau un anion. Consultați tabelul periodic pentru mase, numere atomice și sarcini ionice specifice.
- Ion de aluminiu
- Atom de zirconiu
- Ion de sulf
Soluții
- În ionul de aluminiu există 13 protoni, 14 neutroni și 10 electroni. Acest ion este încărcat pozitiv, ceea ce înseamnă că a pierdut electroni și formează un cation.
- Există 40 de protoni, 51 de neutroni și 40 de electroni în atomul de zirconiu. Acesta este un atom care nu are sarcină totală.
- Există 16 protoni, 16 neutroni și 18 electroni în ionul de sulf. Acest ion este încărcat negativ, ceea ce înseamnă că a câștigat electroni și formează un anion.
Exemplu \(\PageIndex{2}\): Notații de masă A/Z și de masă simbolică
Scrieți notațiile de masă A/Z și de masă simbolică pentru ionii/atomii din întrebarea anterioară.
Soluții
- \(\ce{^{27}_{13}Al^{3+}}\) și Al-27
- \(\ce{^{91}_{40}Zr}\) și Zr-.91
- \(\ce{{^{32}_{16}S}^{2-}\) și S-32
În cazul în care un atom câștigă sau pierde electroni, acest lucru ar trebui să fie reprezentat în formatul A/Z. Formatul simbol-masă nu afișează sarcina ionică. Țineți minte, neutronii și protonii nu sunt afectați de schimbările de electroni.
Nevoie de mai multă practică?
- Revin la secțiunea 3.E din acest OER și rezolvați problemele #5 și #9.
Contribuitori
-
Elizabeth R. Gordon (Furman University)
.